Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 888 questões
Um professor realizou um experimento em um laboratório no qual ele realizou a queima de papel amassado e de esponja de aço, respectivamente, em balanças artesanais, conforme figura 1.

Um professor realizou um experimento em um laboratório no qual ele realizou a queima de papel amassado e de esponja de aço, respectivamente, em balanças artesanais, conforme figura 1.

Uma quantidade igual a 5 g de NaCl é dissolvida em
25 g de água. A fração molar em quantidade de matéria
do NaCl na solução é aproximadamente igual a
Um disco circular feito de alumínio de alta pureza, com 20,0 cm de raio, espessura de 2,0 mm e massa de 675,0 g, gira em torno de um eixo fixo em seu centro, descrevendo ângulos de 30º a cada 2,0 segundos.
Dados:
Considerando o exposto, assinale o que for correto.

Um disco circular feito de alumínio de alta pureza, com 20,0 cm de raio, espessura de 2,0 mm e massa de 675,0 g, gira em torno de um eixo fixo em seu centro, descrevendo ângulos de 30º a cada 2,0 segundos.
Dados:
Considerando o exposto, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Observe atentamente o quadro a seguir, cujos valores de temperatura de ebulição foram medidos sob pressão de 1,0 atm.

Na indústria química, um dos gases mais utilizados é o cloro. Com relação à estrutura de sua molécula, assinale o que for correto.
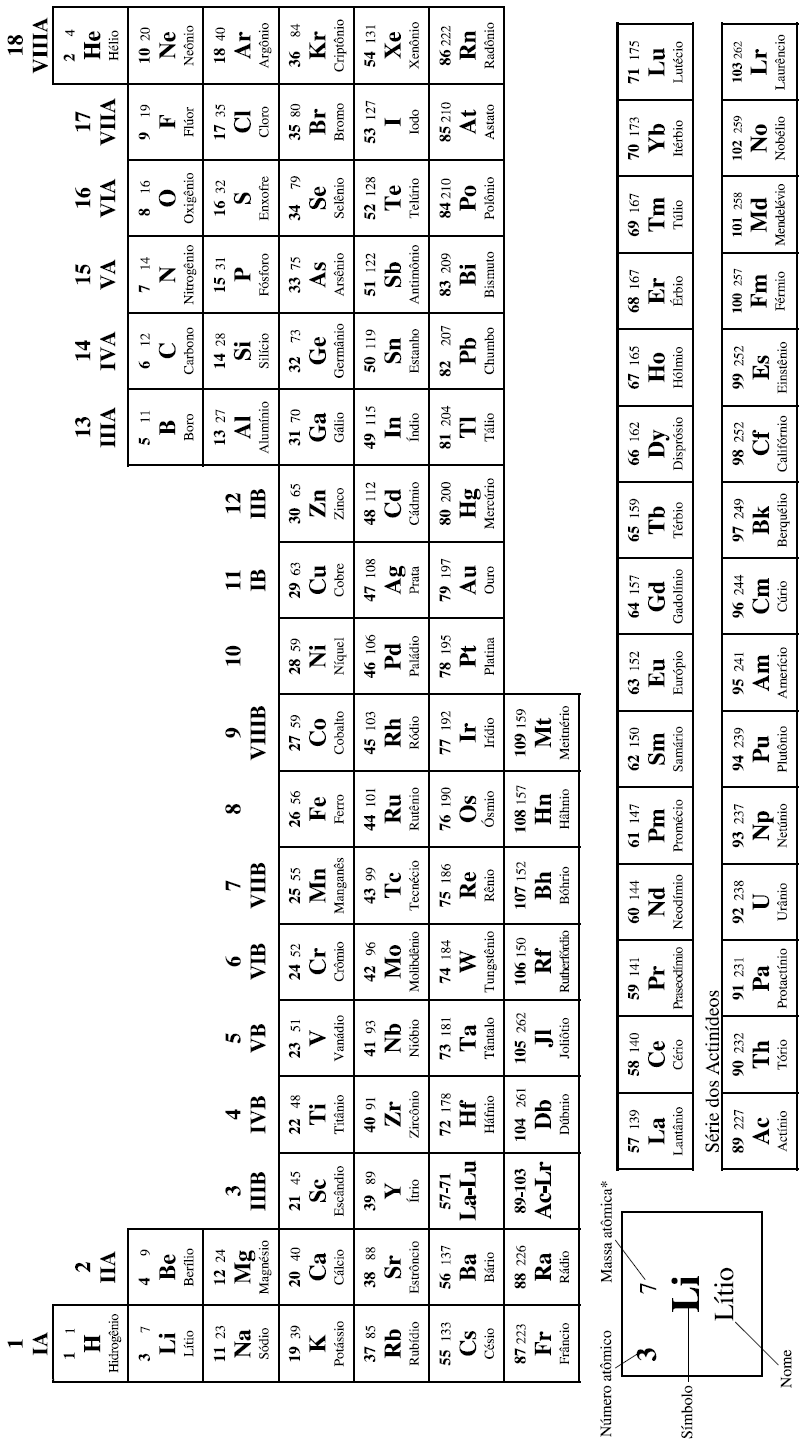
Considerando que a estrutura molecular da fenilalanina está representada na figura
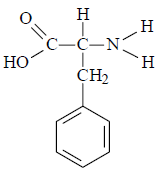
pode-se concluir que sua fórmula química é C9 H11 NO2.

Com a decomposição de 400kg de calcário, se emitem para a atmosfera

A Lei, à qual Lavoisier faz referência no texto, constitui um fundamento essencial para se compreender e representar as reações químicas. Essa Lei é conhecida como
A partir dessas reações, qual a massa mínima (em quilograma), por dia, necessária para eliminar todo o SO2 formado? Para isso suponha que o rendimento é de 100% para as reações citadas.
I. O ferro presente na hematita apresenta número de oxidação igual a +2.
II. De acordo com o processo, para cada mol de hematita adicionada, são utilizados 3 mol de monóxido de carbono.
III. Para um rendimento global igual a 50%, a massa de ferro formada a partir de 1280 kg de hematita é de 448 kg.
IV. O gás carbônico dissolvido em água forma uma solução que apresenta valor de pH maior do que 7.
Dadas as massas molares (g/mol): C = 12, O = 16 e Fe = 56.
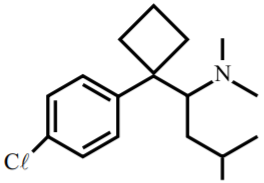
A fórmula estrutural do cloridrato de sibutramina está representada acima e, a respeito da mesma, considere as afirmações:
I. Existe um átomo de carbono terciário com hibridização sp2.
II. Sua fórmula molecular é C17H25NCℓ.
III. Possui 6 elétrons pi ressonantes.
IV. Apresenta os grupos funcionais haleto orgânico e amida.
Estão corretas, somente,
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Considerando apenas a equação I, a massa de azida necessária para a formação de 67,2 L
de N2 nas CNTP seria 130 g.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Na reação global, 10 mol de azida geram 16 mol de nitrogênio gasoso.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns
quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na
rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Considerando apenas a equação I, seriam necessários 650 mg de azida de sódio para gerar
336 mL de N2 nas CNTP.
(C6H10O) n + nH2O → n C6H12O6 glicogênio glicose
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a: