Questões de Vestibular
Sobre representação das transformações químicas em química
Foram encontradas 889 questões

O dodecilbenzeno é um:
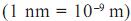 . A aplicação da nanotecnologia é bastante vasta: medicamentos programados para atingir um determi- nado alvo, janelas autolimpantes que dispensam o uso de pro- dutos de limpeza, tecidos com capacidade de suportar condições extremas de temperatura e impacto, são alguns exemplos de projetos de pesquisas que recebem vultuosos investimentos no mundo inteiro.Vidro autolimpante é aquele que recebe uma camada ultrafina de dióxido de titânio. Essa camada é aplicada no vidro na última etapa de sua fabricação. A espessura de uma camada ultrafina constituída somente por
. A aplicação da nanotecnologia é bastante vasta: medicamentos programados para atingir um determi- nado alvo, janelas autolimpantes que dispensam o uso de pro- dutos de limpeza, tecidos com capacidade de suportar condições extremas de temperatura e impacto, são alguns exemplos de projetos de pesquisas que recebem vultuosos investimentos no mundo inteiro.Vidro autolimpante é aquele que recebe uma camada ultrafina de dióxido de titânio. Essa camada é aplicada no vidro na última etapa de sua fabricação. A espessura de uma camada ultrafina constituída somente por 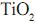 uniformemente distribuído, massa molar 80 g/mol edensidade
uniformemente distribuído, massa molar 80 g/mol edensidade 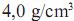 , depositada em uma janela com dimensões de 50 × 100 cm, que contém
, depositada em uma janela com dimensões de 50 × 100 cm, que contém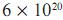 tomos de titânio (constante de Avogadro =
tomos de titânio (constante de Avogadro = 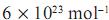 ) é igual a
) é igual a 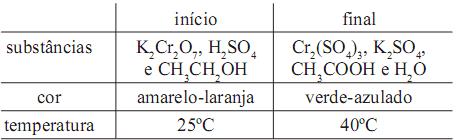
A soma dos índices estequiométricos da equação da reação devidamente balanceada e a classificação desta reação quanto ao calor envolvido são, respectivamente,
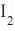 para cada quilograma de álcool, será de
para cada quilograma de álcool, será de
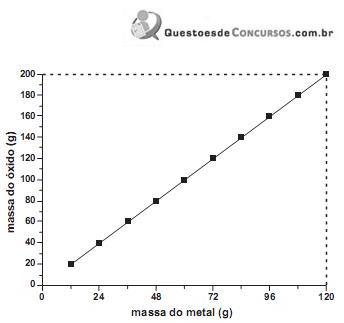
Durante um experimento, realizado em recipiente fechado, foi colocado para reagir 1,00 g do referido metal, obtendo-se 1,40 g do seu óxido. Considerando-se que todo o oxigênio presente no frasco foi consumido, pode-se determinar que a massa de oxigênio presente no sistema inicial é x . Em outro recipiente fechado, foram colocados 1,50 g do referido metal em contato com 1,20 g de oxigênio. Considerando que a reação ocorreu até o consumo total de pelo menos um dos reagentes, pode- se afirmar que amassa de óxido gerado é y . Sabendo que ometal emquestão forma apenas um cátion estável e considerando que em todas as reações o rendimento foi de 100 %, os valores de x e y são, respectivamente,
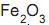 e impurezas. Ao se misturar 4,0 g de uma amostra deste minério com ácido clorídrico concentrado, obtêm- se 6,5 g de cloreto de ferro III. A porcentagem em massa de
e impurezas. Ao se misturar 4,0 g de uma amostra deste minério com ácido clorídrico concentrado, obtêm- se 6,5 g de cloreto de ferro III. A porcentagem em massa de 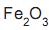 no minério é igual a
no minério é igual aSe a massa de CO2 produzida foi 13,9 g, a quantidade em mol de CO é:
B2O3 + 3Mg → 2B + 3MgO
Partindo-se de 262,5 g do óxido de boro em excesso de magnésio, obteve- se 33 g de B, o que significa que o rendimento percentual (%) da reação foi mais próximo de:

A partir das informações acima, e considerando o número de Avogadro igual a 6 × 1023, julgue os itens seguintes.

A partir das informações acima, e considerando o número de Avogadro igual a 6 × 1023, julgue os itens seguintes.

Considerando as informações acima, julgue os itens 50 e 51, assinale a opção correta no item 52, que é do tipo C, e faça o que se pede no item 53, que é do tipo D.
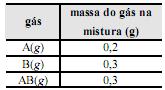
Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.




