Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio iônico: conceitos, diluição de ostwald, efeito do íon comum. em química
Foram encontradas 33 questões
Em água, o produto de solubilidade do AgCl é calculado a partir do equilíbrio indicado na Equação I. Em meio aquoso contendo concentração elevada de amoníaco, forma-se a espécie Ag(NH3)2 +, conforme a Equação II.
AgCl(s)  Ag+(aq) + Cl -(aq) Kps
= 1 x 10-10 (Equação I)
Ag+(aq) + Cl -(aq) Kps
= 1 x 10-10 (Equação I)
Ag+
(aq) + 2NH3(aq)  Ag(NH3)2
+
(aq) Kf
= 1 x 1011 (Equação II)
Ag(NH3)2
+
(aq) Kf
= 1 x 1011 (Equação II)
Num sistema aquoso contendo AgCl(s) e NH3
, tem-se
A solubilidade desse composto a 25.0°C, em água pura e em uma solução de pH igual a 13.00, será, respectivamente, em molL-1 :
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq)  H+ (aq) + CN–
(aq)
H+ (aq) + CN–
(aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
Estudos ambientais revelaram que o ferro é um dos metais presentes em maior quantidade na atmosfera, apresentando- -se na forma do íon de ferro 3+ hidratado, [Fe(H2 O)6 ] 3+. O íon de ferro na atmosfera se hidrolisa de acordo com a equação
[Fe(H2 O)6 ] 3+ ↔ [Fe(H2 O)5 OH]2+ + H+
(Química Nova, vol. 25, n.º 2, 2002. Adaptado) Um experimento em laboratório envolvendo a hidrólise de íons de ferro em condições atmosféricas foi realizado em um reator de capacidade de 1,0 L. Foi adicionado inicialmente 1,0 mol de [Fe(H2 O6 ) ]3+ e, após a reação atingir o equilíbrio, havia sido formado 0,05 mol de íons H+. A constante de equilíbrio dessa reação nas condições do experimento tem valor aproximado igual aI. KCl(aq) + AgNO3(aq) → AgCl(s) + KNO3(aq)
II. FeCl3(aq) + SnCl2(aq) → FeCl2(aq) + SnCl4(aq)
III. Ba(OH)2(aq) + H2SO4(aq) → BaSO4(s) + H2O(l)
Nessas equações, os símbolos (aq), (s) e (l) representam, respectivamente, “espécies químicas dissolvidas em água", “espécies químicas no estado sólido" e “espécies químicas no estado líquido".
É correto afirmar que, na reação indicada, são íons espectadores
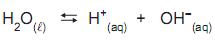
O produto iônico da água é
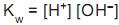 , cujo valor é 1 x
, cujo valor é 1 x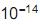 a 25 °C. Ao se adicionar 1,0 mL de NaOH 1,0 mol/L (base forte) a um copo bécher contendo 99 mL de água pura, o pH da solução será aproximadamente igual a
a 25 °C. Ao se adicionar 1,0 mL de NaOH 1,0 mol/L (base forte) a um copo bécher contendo 99 mL de água pura, o pH da solução será aproximadamente igual a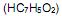 com o hidróxido de sódio. Se em uma solução aquosa 0,072 mol/L de ácido benzóico, no equilíbrio apresenta uma concentração de íons hidrônio
com o hidróxido de sódio. Se em uma solução aquosa 0,072 mol/L de ácido benzóico, no equilíbrio apresenta uma concentração de íons hidrônio 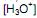 de 2,1 x 10-3 mol/L, qual é o valor de
de 2,1 x 10-3 mol/L, qual é o valor de 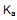 (constante de ionização ácida) deste ácido?
(constante de ionização ácida) deste ácido?PbS (s) ⇄ Pb2- (aq) + S2- (aq) S2- (aq) + 2 H- (aq)⇄ H2S (aq)
Neste gráfico, estão representadas as concentrações de Pb 2+ e S 2– , originadas exclusivamente do PbS, em função do pH da água:
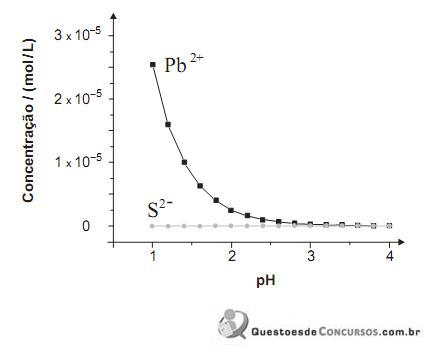
Considere que a incidência de chuva ácida sobre o mesmo lago altera a concentração das espécies envolvidas nos dois equilíbrios.
Com base nessas informações, é CORRETO afirmar que, na situação descrita,
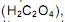 como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.
como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.Considere a informação acima e o equilíbrio a seguir:

Esse equilíbrio está relacionado com as formas do cálcio assimilável pelo intestino humano e com as do não-assimilável.
Uma quantidade elevada de al imentos ricos em oxalato dificulta a absorção de Ca 2+ porque
Assim, quando 25,0 mL de solução de NaCl 0,10 M reage com 5,0 mL de uma solução padrão de AgNO
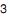 0,20 M (Kps do AgCl = 1,0x10-10 ), pode-se afirmar que
0,20 M (Kps do AgCl = 1,0x10-10 ), pode-se afirmar que