Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio iônico: conceitos, diluição de ostwald, efeito do íon comum. em química
Foram encontradas 33 questões
Com base no texto anterior e nas informações precedentes e considerando que 1 L = 1 dm3 , julgue o item.
Em solução aquosa, o ácido cítrico sofre três reações de dissociação ácida, cujas equações químicas estão corretamente expressas a seguir.
C6H8O7(aq) + H2O(l) ⇌ C6H7O7 − (aq) + H3O+ (aq)
C6H7O7 − (aq) + H2O(l) ⇌ C6H6O7 2−(aq) + H3O+ (aq)
C6H6O7
2−(aq) + H2O(l) ⇌ C6H5O7
3−(aq) + H3O+
(aq)
Com base no texto anterior e nas informações precedentes e considerando que 1 L = 1 dm3 , julgue o item.
A primeira constante de dissociação ácida do ácido cítrico
(Ka1) é superior a 10−3.
Considerando as informações do texto apresentado, julgue o item a seguir.
Considere que, no tratamento da água com hipoclorito de sódio, ocorra a seguinte reação, que tem constante de equilíbrio Kb = 1,0 × 10−7.
ClO− (aq) + H2O(l) ⇌ HClO(aq) + OH− (aq)
Nessa situação, em uma solução aquosa em que essa reação ocorre a pH = 6, a quantidade de mols de HClO é igual à quantidade de mols de ClO− no equilíbrio.
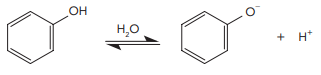
Considere um processamento no qual houve a dissolução completa de 0,01 mol de fenol em água para formar 1 L de solução a 20 °C. Nessa temperatura, a constante de acidez do fenol é igual a 10−10. Atingido o equilíbrio químico da ionização, a concentração de ânion fenolato, em mol/L, na solução, é aproximadamente igual a:
Para estudar equilíbrio químico de íons Co2+ em solução, uma turma de estudantes realizou uma série de experimentos explorando a seguinte reação:
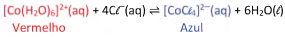
Nesse equilíbrio, o composto de cobalto com água, [Co(H2O)6]2+(aq), apresenta coloração vermelha, enquanto o composto com cloretos, [CoCl4]2-(aq), possui coloração azul.
Para verificar o efeito de ânions de diferentes sais nessa mudança de cor, 7 ensaios diferentes foram realizados. Aos tubos contendo apenas alguns mL de uma solução de nitrato de cobalto II, de coloração vermelha, foram adicionadas pequenas quantidades de diferentes sais em cada tubo, como apresentado na tabela, com exceção do ensaio 1, no qual nenhum sal foi adicionado.
Após agitação, os tubos foram deixados em repouso por um tempo, e a cor final foi observada.
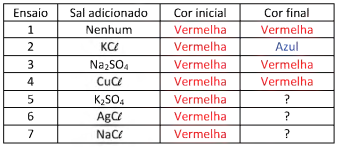
A alternativa que representa a cor final observada nos ensaios 5, 6 e 7, respectivamente, é:
Note e adote:
Solubilidade dos sais em g/100 mL de água a 20 °C
AgCℓ 1,9 x 10-4 NaCℓ 35,9
CuCℓ 9,9 x 10-3 Na2SO4 13,9
KCℓ 34,2 K2SO4 11,1
BaSO4 (s) → Ba2+(aq) + SO4 2- (aq) K2SO4 (s) → 2K+ (aq) + SO4 2- (aq)
A função do sulfato de potássio nessa situação é:
Sob temperatura constante, acrescentou-se cloreto de sódio em água até sobrar sal sem se dissolver, como corpo de fundo. Estabeleceu-se assim o seguinte equilíbrio:
NaCℓ (s) ⇌ Na+ (aq) + Cℓ – (aq)
Mantendo a temperatura constante, foi acrescentada mais uma porção de NaCℓ (s). Com isso, observa-se que a condutibilidade elétrica da solução sobrenadante ________ , a quantidade de corpo de fundo _______________ e a concentração de íons em solução ________ .
As lacunas do texto devem ser preenchidas, respectivamente, por:
DADOS QUE PODEM SER USADOS NESTA PROVA:

A quimioesfoliação (peeling químico) consiste na aplicação de substâncias químicas na pele, visando à renovação celular e eliminação de rugas. Apesar de envolver algum risco à saúde, algumas pessoas utilizam esse processo para manter uma imagem jovem. Para um peeling superficial ou médio, costuma-se usar uma solução da seguinte substância:
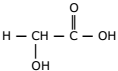
Atente ao que se diz a respeito dessa substância:
I. Essa substância é um éster.
II. Libera H+ quando se encontra em solução aquosa.
III. Uma diminuição da concentração de H+ leva também a uma diminuição do pH.
IV. Na reação de ionização, essa substância se transforma na seguinte espécie:
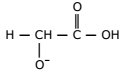
É correto o que se afirma somente em
TEXTO 4
Não desejei a morte de minha filha. Ou desejei? Aí é que reside a dúvida, é onde habita o nó que nada nem ninguém no mundo tem o poder de desatar. O inconsciente, desculpe-me a vulgaridade do termo, minha filha, é uma merda. Sendo autônomo, o inconsciente age por si, sem pedir licença nem se revelar. Desejei ou não a morte de minha filha, hein? Você pode responder a essa pergunta? Alguém pode? Eu não posso. Busquei na fonte a resposta e ela não veio. Como minha filha havia feito, busquei nas águas do Cristal a cura imediata para uma dor que parecia infinda. A ferida tinha sido cavada pelas águas, então elas que tratassem de cicatrizá-la. O rio recusou meu corpo, mas não a dor. Nem o aconselhamento. Pediu tempo, apenas. Permaneci plantada no barranco, juntando ao seu caudal minhas lágrimas secas. Disseram que eu tinha enlouquecido, talvez tivesse mesmo. Em diálogo profundo, as águas me fizeram compreender verdades para as quais eu nunca havia me atinado. Todo rio tem seu leito, suas margens, seu limite, toda vez que ele avança além de seu leito original provoca estragos, descalabros. O rio de nossa vida não é diferente. Ele também está sujeito a limitações intransponíveis. Existe você e você; seu campo de visão, a capacidade de administrar o próprio caudal. Tem a hora de abrir e a hora de fechar as comportas. Felicidade ou dor, a escolha é sua, depende do grau de intensidade que você der a cada coisa. Hoje posso dizer que me conheço um pouquinho, mesmo assim, perguntas continuam sem resposta.
(BARROS, Adelice da Silveira. Mesa dos inocentes. Goiânia: Kelps, 2010. p. 23.)
O Texto 4 faz menção a rio, que, muitas vezes é o destino final dos dejetos produzidos pela nossa sociedade. São várias as substâncias que os homens despejam nos rios, causando com isso diversos problemas ambientais. Dentre essas substâncias, podemos encontrar vários compostos inorgânicos, como sais, bases e ácidos. Analise as afirmativas a seguir:
I - A hidrólise de um sal proveniente de ácido forte e uma base fraca em água resultará na redução do pH.
II - Na hidrólise de um sal proveniente de um ácido fraco e base forte, a redução do pOH está em função do deslocamento do equilíbrio (da reação de autoionização da água) para a direita.
III - A adição de NaCl à água provoca a hidrólise desta, por se tratar de um sal proveniente de uma ácido e uma base fracos.
IV - A adição NaCl à água provoca a hidrólise desta, alterando-lhe o equilíbrio iônico.
Em relação às proposições analisadas, assinale a única alternativa cujos itens estão todos corretos:
Dados:
Constante de ionização (Ka) do H₂CO₃ = 4 x 10⁻⁷
Constante de ionização (Kb) do NH₃= 2 x 10⁻⁵
Constante de ionização (Kw) do H₂O = 1 x 10⁻¹⁴
Os indicadores ácido base são substâncias cuja cor se altera em uma faixa específica de pH. Atabela a seguir apresenta afaixa de viragem (mudança de cor) de alguns indicadores ácido base.
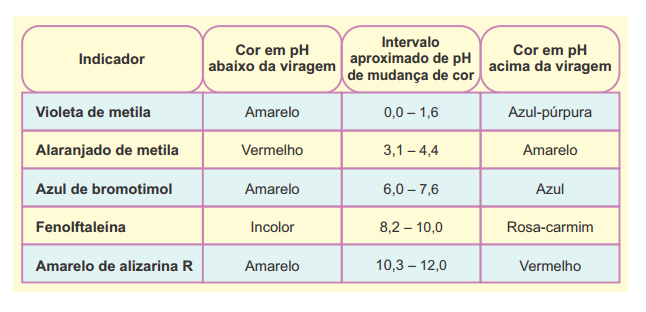
A partir da análise dessa tabela, um técnico executou um procedimento para distinguir algumas soluções.
Para diferenciar uma solução de 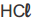 de concentração 1,0 mol.L⁻¹ de uma solução de
de concentração 1,0 mol.L⁻¹ de uma solução de 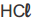 e concentração 0,01 mol.L⁻¹ ele utilizou o indicador X. Para diferenciar uma solução de bicarbonato de sódio (NaHCO₃) de concentração 0,01 mol.L⁻¹ ele utilizou o indicador Y. Para diferenciar uma solução de amoníaco (NH₃) de concentração 1,0 x 10⁻³ mol.L⁻¹ de uma solução de hidróxido de sódio (NaOH) de concentração 0,1 mol.L⁻¹ ele utilizou o indicador Z.
e concentração 0,01 mol.L⁻¹ ele utilizou o indicador X. Para diferenciar uma solução de bicarbonato de sódio (NaHCO₃) de concentração 0,01 mol.L⁻¹ ele utilizou o indicador Y. Para diferenciar uma solução de amoníaco (NH₃) de concentração 1,0 x 10⁻³ mol.L⁻¹ de uma solução de hidróxido de sódio (NaOH) de concentração 0,1 mol.L⁻¹ ele utilizou o indicador Z.
A alternativa que apresenta os indicadores X, Y e Z adequados para cada um dos procedimentos propostos pelo técnico é
Uma solução aquosa de nitrato de prata (0,050 mol L -1 ) é usada para se determinar, por titulação, a concentração de cloreto em uma amostra aquosa. Exatos 10,00 mL da solução titulante foram requeridos para reagir com os íons Cl- presentes em 50,00 mL de amostra. Assinale a concentração, em mol L-1 , de cloreto, considerando que nenhum outro íon na solução da amostra reagiria com o titulante.
Dado: Ag+ (aq) + Cl- (aq) → AgCl(s)
Em linhas gerais, o consumo de água aumentou de forma considerável em todo o planeta ao longo do tempo. Em 1900, o mundo consumia cerca de 580 km³ de água; já em 1950, esse consumo elevou-se para 1400 km³, passando para 4000 km³ em 2000. Segundo previsões da ONU, é provável que em 2025 o nível de consumo eleve-se para 5200 km³. A despeito dessa elevação da utilização da água, registra-se também o aumento do número de pessoas sem fácil acesso à água potável, totalizando 1,1 bilhão em todo o planeta a sofrer com esse problema.
Além da utilização exagerada na área doméstica e no plano individual, soma-se o intensivo consumo de água nas atividades econômicas, notadamente a agricultura e a indústria, isso sem contar o grande volume desperdiçado. Não por acaso, a maior parte do consumo mundial de água acontece nos países desenvolvidos. Os emergentes ou subdesenvolvidos consomem em menor quantidade em razão do menor acesso à água e da menor intensidade das práticas econômicas. Segundo a ONU, o consumo dos países centrais é seis vezes maior do que o consumo dos países periféricos.
Fonte: http://brasilescola.uol.com.br/geografia/consumo-agua-no-mundo.htm
Em água, o produto de solubilidade do AgCl é calculado a partir do equilíbrio indicado na Equação I. Em meio aquoso
contendo concentração elevada de amoníaco, forma-se a espécie Ag(NH3
)2+, conforme a Equação II.
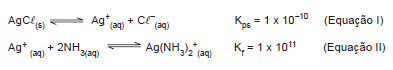
Num sistema aquoso contendo AgCl(s) e NH3
, tem-se
Em água, o produto de solubilidade do AgCl é calculado a partir do equilíbrio indicado na Equação I. Em meio aquoso contendo concentração elevada de amoníaco, forma-se a espécie Ag(NH3)2 +, conforme a Equação II.
AgCl(s)  Ag+(aq) + Cl -(aq) Kps
= 1 x 10-10 (Equação I)
Ag+(aq) + Cl -(aq) Kps
= 1 x 10-10 (Equação I)
Ag+
(aq) + 2NH3(aq)  Ag(NH3)2
+
(aq) Kf
= 1 x 1011 (Equação II)
Ag(NH3)2
+
(aq) Kf
= 1 x 1011 (Equação II)
Num sistema aquoso contendo AgCl(s) e NH3
, tem-se
HCN (aq) ⇔ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro: grau de ionização
Símbolo: α
Parâmetro: constante de equilíbrio
Símbolo: Ka
Parâmetro: potencial hidrogeniônico
Símbolo: pH
Parâmetro: concentração de HCN
Símbolo: [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
A solubilidade desse composto a 25.0°C, em água pura e em uma solução de pH igual a 13.00, será, respectivamente, em molL-1 :
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq)  H+ (aq) + CN–
(aq)
H+ (aq) + CN–
(aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
Estudos ambientais revelaram que o ferro é um dos metais presentes em maior quantidade na atmosfera, apresentando- -se na forma do íon de ferro 3+ hidratado, [Fe(H2 O)6 ] 3+. O íon de ferro na atmosfera se hidrolisa de acordo com a equação
[Fe(H2 O)6 ] 3+ ↔ [Fe(H2 O)5 OH]2+ + H+
(Química Nova, vol. 25, n.º 2, 2002. Adaptado) Um experimento em laboratório envolvendo a hidrólise de íons de ferro em condições atmosféricas foi realizado em um reator de capacidade de 1,0 L. Foi adicionado inicialmente 1,0 mol de [Fe(H2 O6 ) ]3+ e, após a reação atingir o equilíbrio, havia sido formado 0,05 mol de íons H+. A constante de equilíbrio dessa reação nas condições do experimento tem valor aproximado igual a