Questões de Vestibular
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 436 questões
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Assumindo que a concentração de SO2 em uma solução é de 1 x 10-3 mols por litro, uma alíquota de 200 ml dessa solução terá aproximadamente 6,4 mg de dióxido de enxofre.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Sabendo-se que o soro fisiológico é uma solução isotônica em relação aos líquidos corporais e que o mesmo contém 0,6% (massa/volume) de NaCl em água, sua concentração em mol/ℓ será aproximadamente 0,1.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
São necessários 42 g de fluoreto de sódio para fluoretar 38.000 litros de água, de tal modo que a concentração de íons fluoreto seja 0,5 ppm (partes por milhão).
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Uma bebida alcoólica que possui 10% em massa de etanol e densidade igual a 0,97 g/mℓ terá uma concentração aproximada de 2,1 mol/ℓ.
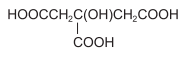
Ácido cítrico
A partir dessas informações, é correto afirmar:
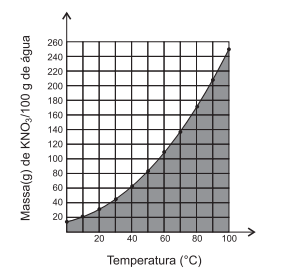
O gráfico representa a variação do coeficiente de solubilidade de nitrato de potássio com a temperatura.
Uma análise desse gráfico permite afirmar:
Determinada espécie de peixes, a exemplo dos salmões, é capaz de perceber a presença na água de 2-fenil-etanol, representado pela fórmula química, em concentrações muito pequenas, como a de 4,0g em 1,0.1014L.
A análise dessas informações permite afirmar:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
Os coeficientes de solubilidade (C.S.) aproximados do cloreto de potássio e do dicromato de potássio, em g/100 g de H2O, são fornecidos na tabela a seguir:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Os coeficientes de solubilidade (C.S.) aproximados do cloreto de potássio e do dicromato de potássio, em g/100 g de H2O, são fornecidos na tabela a seguir:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Os coeficientes de solubilidade (C.S.) aproximados do cloreto de potássio e do dicromato de potássio, em g/100 g de H2O, são fornecidos na tabela a seguir:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Os coeficientes de solubilidade (C.S.) aproximados do cloreto de potássio e do dicromato de potássio, em g/100 g de H2O, são fornecidos na tabela a seguir:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Os coeficientes de solubilidade (C.S.) aproximados do cloreto de potássio e do dicromato de potássio, em g/100 g de H2O, são fornecidos na tabela a seguir:
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)

De acordo com os parâmetros atuais de monitoramento ambiental, as águas de superfície não devem conter mais que 0,78 mg/L de cromo. Sabendo-se que a densidade da água pura a 25 °C é 1,0 g/mL, assinale o que for correto.

De acordo com os parâmetros atuais de monitoramento ambiental, as águas de superfície não devem conter mais que 0,78 mg/L de cromo. Sabendo-se que a densidade da água pura a 25 °C é 1,0 g/mL, assinale o que for correto.

De acordo com os parâmetros atuais de monitoramento ambiental, as águas de superfície não devem conter mais que 0,78 mg/L de cromo. Sabendo-se que a densidade da água pura a 25 °C é 1,0 g/mL, assinale o que for correto.

De acordo com os parâmetros atuais de monitoramento ambiental, as águas de superfície não devem conter mais que 0,78 mg/L de cromo. Sabendo-se que a densidade da água pura a 25 °C é 1,0 g/mL, assinale o que for correto.

De acordo com os parâmetros atuais de monitoramento ambiental, as águas de superfície não devem conter mais que 0,78 mg/L de cromo. Sabendo-se que a densidade da água pura a 25 °C é 1,0 g/mL, assinale o que for correto.
A questão se refere ao texto a seguir.
Na agricultura, é muito comum a utilização de fertilizantes agrícolas, os quais contêm normalmente três ingredientes principais:
I. Nitrogênio (numa forma combinada, comumente nitrato de amônio ou outros sais de amônio ou ureia);
II. Fósforo (usualmente na forma de fosfatos solúveis);
III. Potássio (na forma de sais, como o sulfato de potássio).
Sobre essas informações, assinale o que for
correto.
As reações que acontecem no interior da bateria estão representadas abaixo.
Ânodo: Pb(s) + HSO4-(aq) + H2O(ℓ) → PbSO4(s) + H3O+(aq) + 2e- Cátodo: PbO2(s) + 3H3O+(aq) + HSO4-(aq) + 2e- → PbSO4(s) + 5H2O(ℓ)
A respeito das baterias de chumbo, considere as afirmações I, II, III e IV.
I. A concentração da solução de ácido sulfúrico utilizada na bateria é de aproximadamente 390 g/L. II. Um derramamento da solução de bateria pode ser neutralizado com uma solução de cloreto de amônio. III. Uma solução de bateria pode ser preparada a partir da diluição de 100 mL de ácido sulfúrico, 18 mol/L, com água pura, até volume final de 1 L. IV. A equação Pb(s) + PbO2(s) + 2H3O+(aq) + 2 HSO4-(aq) → 2 PbSO4(s) + 4H2O(ℓ) representa a reação global que ocorre na bateria.
Dado: massa molar do H2SO4 = 98 g/mol.
Dessas afirmações, estão corretas, apenas