Questões de Vestibular
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 433 questões

Considerando o texto acima e aspectos a ele relacionados, julgue
o item que se segue.

A partir das informações do texto, julgue o item seguinte.
Considerando-se essas informações a análise de texto e admitindo-se que a densidade da água é 1,0g/cm3 , é correto afirmar:
1. Adição de 20 mL de água a uma solução aquosa saturada em cloreto de sódio, contendo um grande excesso de sal sedimentado, tal que ainda permaneça precipitado após a adição de mais solvente. 2. Adição de 20 mL de água a uma solução aquosa não saturada em cloreto de sódio. 3. Retirada de fenol, solúvel em água e em éter etílico, de uma solução aquosa, por agitação com uma porção de éter etílico seguida por separação da fase orgânica da fase aquosa. 4. Dissolver glicose em água e a esta solução juntar etanol para que surjam novamente cristais de glicose. 5. Adição de 20 mL de água a nitrato de potássio cristalino.
a) Dissolução b) Extração c) Diluição d) Recristalização
Na preparação de uma solução diluída, com base em uma mais concentrada, retira-se um volume de solução concentrada de hidróxido de sódio (NaOH) 1 mol/L para se preparar 500 mL de uma solução diluída de 0,2 mol/L.
Se C1V1=C2V2, o volume inicial de solução de NaOH 1 mol/L retirado para se obter a solução diluída corresponderá a:
A tartrazina é uma substância muito utilizada para colorir alimentos. No entanto, estudos apresentam a ocorrência de alergias principalmente em pessoas sensíveis ao ácido acetilsalicílico, porém sem resultados conclusivos. Para efeito da utilização da tartrazina como aditivo alimentar, a Agência Nacional de Vigilância Sanitária (ANVISA) define seu limite máximo de 30 mg por 100 gramas de amostra e um IDA (Ingestão Diária Aceitável) de 7,5 mg/Kg de peso corpóreo para tartrazina.
A tartrazina é uma substância muito utilizada para colorir alimentos. No entanto, estudos apresentam a ocorrência de alergias principalmente em pessoas sensíveis ao ácido acetilsalicílico, porém sem resultados conclusivos. Para efeito da utilização da tartrazina como aditivo alimentar, a Agência Nacional de Vigilância Sanitária (ANVISA) define seu limite máximo de 30 mg por 100 gramas de amostra e um IDA (Ingestão Diária Aceitável) de 7,5 mg/Kg de peso corpóreo para tartrazina.
LIMA, A.C.S.; AFONSO, C., A Química dos Refrigerantes. Química Nova na Escola, 31(3), 2009. (adaptado)
As duas palavras que completam o texto são, respectivamente:
Dados: R = 0,082 atm.L/mol.K

Esse recipiente tem altura H, em centímetros, equivalente a :
Os quadros abaixo comparam as informações nutricionais para porções iguais de dois tipos de sal:

 (aq), adicionou-se água pura, em quantidade sufciente para se obterem 100,0 mL de solução diluída.
(aq), adicionou-se água pura, em quantidade sufciente para se obterem 100,0 mL de solução diluída.Considerando-se essas informações, é CORRETO afrmar que o pH da solução resultante é
Na preparação de uma solução di luída, com base em uma mais concentrada, retira-se um volume de solução concentrada de hidróxido de sódio (NaOH) 1 mol/L para se preparar 500 mL de uma solução di luída de 0,2 mol/L. Se
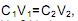 o volume inicial de solução de NaOH 1 mol/L retirado para se obter a solução di luída corresponderá a:
o volume inicial de solução de NaOH 1 mol/L retirado para se obter a solução di luída corresponderá a: 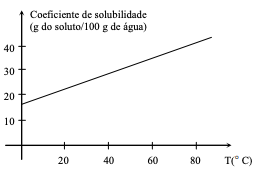
A partir dos dados constantes do gráfico, pode-se afirmar:
I - Colocando-se, em água, uma quantidade de sal superior à sua solubilidade, obtém-se uma solução saturada em equilíbrio com a porção do sal não dissolvida, formando um sistema homogêneo. II - Detecta-se experimentalmente que as concentrações dos íons H3O+ e OH− para as soluções salinas podem ou não ser alteradas em relação às da água pura e que soluções de cloreto de amônio (NH4Cl) são alteradas, com a concentração de H3O+ aumentando e de OH− diminuindo, assim, tem-se que soluções de cloreto de amônio são ácidas. III - Sais que formam soluções básicas têm um ânion capaz de reagir com a água, alterando, para maior, a concentração do íon OH− . IV - A reação de hidrólise de qualquer sal ocorre sempre com a formação de um ácido ou uma base fraca.
Estão corretas as afirmativas
Um estudante de química prepara 1 litro de cada solução aquosa abaixo.
Solução I: Cloreto de sódio (NaCl): 0,26 molar
Solução II: Nitrato de cálcio [Ca(NO3)2]: 0,15 molar
Solução III: Sulfato de alumínio [Al2(SO4)3]: 0,11 molar
A relação entre as massas dos cátions presentes nas soluções é bem
próxima de: