Questões de Vestibular
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 436 questões
Um indicador de poluição difusa de água subterrânea é o nitrato. Sua origem está relacionada a atividades agrícolas e esgotos sanitários. Sendo o nitrato uma forma estável de nitrogênio em condições anaeróbias, esta substância pode ser considerada persistente e sua remoção da água, para atender ao padrão de potabilidade que é de 10 mg/L, é onerosa e, por vezes, tecnicamente inviável, prejudicando o abastecimento público e privado.
Disponível em: <http://www.cetesb.sp.gov.br/Solo/agua_sub/poluicao.asp> Acesso em: 03 set. 2010. (Adaptado)
Considere as seguintes reações utilizadas para a determinação de nitrato.
Sobre o assunto e as reações acima, assinale a proposição CORRETA.
Para que uma amostra de água atenda ao padrão de potabilidade, utilizando-se o método
descrito pelas reações acima, o valor determinado do diazocomposto deve ser menor que
0,01 mol L-1
.
Texto I:
Matar ou morrer
Ao longo dos anos, tem-se tornado cada vez mais necessário aumentar a produtividade agrícola, visando à produção de alimentos. Já nos ambientes urbanos, o controle dos diversos tipos de pragas e insetos é fundamental para a garantia da saúde pública. Para esses fins, passou-se a utilizar, cada vez mais, não só fertilizantes, como também pesticidas, incluindo os inseticidas, herbicidas e fungicidas. Dentre os inseticidas, a Deltametrina é amplamente utilizada no controle de pragas de diversas culturas, no combate de insetos domésticos, dentre outros. O amplo uso da Deltametrina justifica-se por sua potente ação inseticida, toxicidade relativamente baixa em mamíferos e persistência limitada no meio ambiente. Algumas de suas características físicas e químicas estão listadas na tabela abaixo:
TABELA - Características físicas e químicas da Deltametrina
Estado físico pó cristalino
Cor sem cor
Odor sem odor
Densidade (20 ºC) 0,5 g/cm3
Massa Molar 505,24 g/mol
Ponto de fusão 98 – 101 ºC
Ponto de ebulição acima de 300 ºC
Solubilidade em água (20 ºC) < 0,002 mg/L
Solubilidade em solventes orgânicos Solúvel
Solubilidade em Acetona 500 g/L
FONTE: WHO - WORLD HEALTH ORGANIZATION. Environmental Health Criteria 97 – Deltamethrin. Geneva: International Program on Chemical Safety - IPCS, 1990.
A formula estrutural da Deltametrina é apresentada na figura abaixo:

Comumente, a indústria química comercializa o inseticida Deltametrina com as seguintes especificações:
cada 1000 mL contém:
Deltametrina..............25 g
Veículo q.s.p.............1000 mL
No rótulo desse produto há também recomendações para dilução em água para sua aplicação final, de acordo com a tabela abaixo.
Quantidade de água Moscas Insetos rasteiros
1 litro 6 mL 8 mL
10 litros 60 mL 80 mL
20 litros 120 mL 160 mL
Responda a questão com base nas informações dadas sobre o tema “inseticidas” e em seus conhecimentos
de química.
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
COOH
Ácido Cítrico
O ácido cítrico, responsável pela acidez das frutas cítricas, é utilizado como acidificante e flavorizante no processamento de alguns alimentos.
A partir dessas informações, é correto afirmar:
O cromato de potássio, K2 CrO4 , é um sólido amarelo muito solúvel em água, utilizado em laboratórios de análises químicas e em pirotecnia. Uma amostra de K2 CrO4 foi adicionada a um béquer com água a 25 °C. Após intensa agitação, o sistema entrou em equilíbrio e, em seguida, passou por uma filtração. A figura a seguir representa esquematicamente todo o processo.
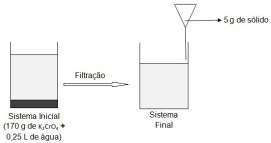
Sobre o processo descrito acima, é CORRETO afirmar que
Considerando as informações constantes na tabela, assinale a alternativa correta.
Composto Solubilidade a 18ºC (mol/L)
HCl 9,4
AgNO3 8,3
AgCl 10-5
KNO3 2,6
KCl 3,9
Sendo assim, considerando uma piscina de formato retangular que tenha 10 m de comprimento, 5 m de largura e 2 m de profundidade, quando cheia de água,a massa máxima de sulfato de cobre que poderá se dissolver é, em gramas, igual a
Dado: 1m3 = 1 000 L
Ao chegar ao Rio, de Corumbá, Fuentes hospedou-se no Hotel Bragança, na avenida Mem de Sá. Um hotel cheio de turistas argentinos falando portunhol. [...] Na lista telefônica Fuentes escolheu um oftalmologista de nome espanhol, Pablo Hernandez. O dr. Hernandez descendia de uruguaios e, para desapontamento de Fuentes, não falava espanhol. Em seu bem montado consultório, na avenida Graça Aranha, na Esplanada do Castelo, examinou Fuentes cuidadosamente. O cristalino, a íris, a conjuntiva, o nervo ótico, os músculos, artérias e veias do aparelho ocular estavam perfeitos. A córnea, porém, fora atingida. Didaticamente Hernandez explicou ao seu cliente que a córnea era uma camada externa transparente através da qual a luz – e com a luz, a cor, a forma, o movimento das coisas – penetrava no olho.
Córnea – moça, 24ª , vende. Tel. 185-3944. O anúncio no O Dia foi lido por Fuentes. Ele ligou de seu quarto, no Hotel Bragança. Atendeu uma mulher...[...] Ela disse que ele podia pegar um ônibus no largo de São Francisco. “É para você?”, perguntou a mulher quando Fuentes lhe falou que era a pessoa que havia telefonado. [...] “Sim, é para mim.” A mulher não ter percebido a cicatriz no seu olho esquerdo deixou Fuentes satisfeito. [...] “Dez milhas”, disse a mulher impaciente. “E não é caro. O preço de um carro pequeno. Minha filha é muito moça, nunca teve doença, dentes bons, ouvidos ótimos. Olhos maravilhosos.”
(FONSECA, Rubem. A Grande Arte. São Paulo: Companhia das Letras, 2008. p. 137-139.)
Com base em algumas ideias do texto 02, foram elaboradas as proposições abaixo. Marque a única correta:
Instruções: Leia atentamente o texto abaixo para responder a
questão.
Banana, a fruta mais consumida e perigosa do mundo


(Adaptado de Sergio Augusto, O Estado de S. Paulo, 26/04/2008)
Dado: Massa molar da sacarose = 342 g . mol−1
Observe, a seguir, a fórmula estrutural do ácido ascórbico, também conhecido como vitamina C:
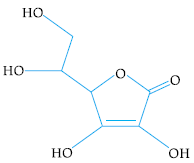
Para uma dieta saudável, recomenda-se a ingestão diária de 2,5 x 10-4 mol dessa vitamina, preferencialmente obtida de fontes naturais, como as frutas.
Considere as seguintes concentrações de vitamina C:
- polpa de morango: 704 mg.L-1;
- polpa de laranja: 528 mg.L-1.
Um suco foi preparado com 100 mL de polpa de morango, 200 mL de polpa de laranja e 700 mL de água.
A quantidade desse suco, em mililitros, que fornece a dose diária recomendada de vitamina C é:
Dado: Kc = 1,86ºC/molal

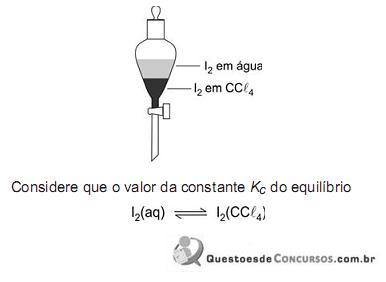
é igual a 100, à temperatura do experimento, para concentrações expressas em moI/L.
Assim sendo, o que é correto afirmar a respeito do sistema descrito?
Frasco 1: 100 mL de H2O( L )
Frasco 2: 100 mL de solução aquosa de ácido acético de concentração 0,5 mol/L
Frasco 3: 100 mL de solução aquosa de KOH de concentração 1,0 mol/L
Frasco 4: 100 mL de solução aquosa de
 de concentração 1,2 mol/L
de concentração 1,2 mol/L