Questões de Vestibular
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 436 questões
(NH4 )2 SO4(s) --------> NH4 +(aq) + SO4 = (aq).
Supondo que se dissolvem 1,32 g de sulfato de amônio em 0,500 litros de água, pode-se afirmar que as concentrações em mols.L-1 de NH4 +(aq) e de SO4 = (aq), respectivamente, são
As tabelas I, II e III mostram os valores limites para o veículo em questão e os valores medidos.

Analisando-se esses dados, conclui-se que o veículo submetido à inspeção deve ter sido
Distribuição esquemática de íons
de um sal dissolvido em água
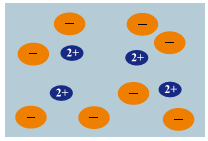
O composto que representa melhor a solução esquematizada na figura é:
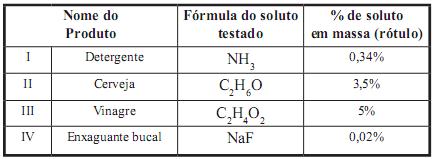
onsiderando que as soluções sejam formadas exclusivamente pelo soluto testado e que suas densidades sejam 1,0 g/mL, o aluno chegou às seguintes conclusões:
I) 1 mol de NH3 em 500 mL de detergente.
II) 21 g de C2 H6 0 em 600 mL de cerveja.
III) 25 g de C2 H4 O2 em 1000 mL de vinagre.
IV) 0,1 mol de NaF em 60 mL de enxaguante bucal.
Assinale a alternativa em que o produto nomeado relaciona CORRETAMENTE a percentagem, em massa, contida no rótulo e os valores encontrados na conclusão do aluno:
Considere que, na determinação do teor de AAS em um medicamento, tenham sido utilizados 50 mL de NaOH 0,1 mol/L na titulação da aspirina em um comprimido de massa igual a 1,00 g. Nesse caso, o percentual em massa de aspirina no comprimido é menor que 95%.
Por meio de filtração simples ou centrifugação de uma solução aquosa não saturada de nitrato de amônio, é possível a obtenção de nitrato de amônio sólido.
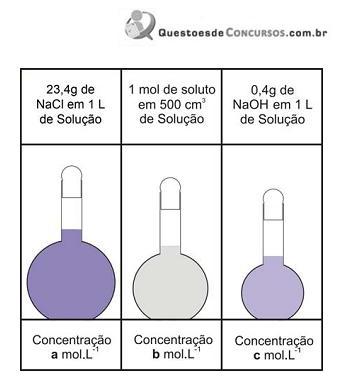
A figura ao lado mostra três soluções com as respectivas quantidades de solutos, utilizados em sua preparação.
A análise da figura permite concluir que os valores das concentrações a, b e c são, respectivamente,
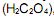 por exemplo, é um composto utilizado para corrigir a concentração de soluções alcalinas por meio da técnica de titulometria. Uma alíquota de 5,0 mL de uma solução de H2C2O4 0,100 mol/L foi titulada com uma solução de NaOH 0,100 mol/L, utilizando-se a fenolftaleí na como indicador. De acordo com a equação química (não balanceada) apresentada a seguir
por exemplo, é um composto utilizado para corrigir a concentração de soluções alcalinas por meio da técnica de titulometria. Uma alíquota de 5,0 mL de uma solução de H2C2O4 0,100 mol/L foi titulada com uma solução de NaOH 0,100 mol/L, utilizando-se a fenolftaleí na como indicador. De acordo com a equação química (não balanceada) apresentada a seguir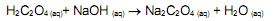
o volume esperado para observação do ponto de viragem é:
O formol é uma solução aquosa de metanal a 40% (em massa) e com densidade 0,92 g/mL. Sobre essa solução, pode-se afirmar que apresenta:
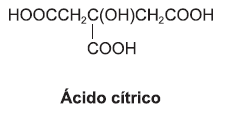
O ácido cítrico, responsável pela acidez das frutas cítricas, é utilizado como acidificante e flavorizante no processamento de alguns alimentos.
A partir dessas informações, é correto afirmar:

