Questões de Vestibular
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 436 questões

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.
O texto abaixo está presente na legislação que institui o Código de Trânsito Brasileiro- CTB.
“[...]Conduzir veículo automotor, na via pública, estando com concentração de álcool por litro de sangue igual ou superior a 6 (seis) decigramas, ou sob a influência de qualquer outra substância psicoativa que determine dependência: Penas - detenção, de seis meses a três anos, multa e suspensão ou proibição de se obter a permissão ou a habilitação para dirigir veículo automotor. [...]”
Um condutor automotivo parado em uma operação policial, após ser submetido a análises técnicas, apresentou uma concentração de 21 decigramas de álcool por litro de sangue.
Com base no texto acima e nos conceitos químicos, analise as afirmações a seguir.
I- A concentração de álcool no sangue desse condutor é de 2,1μg/μL.
II- O condutor deverá ser penalizado segundo a legislação do CTB.
III- Caso o condutor possua em seu organismo um volume de sangue igual a 5,0 L, a quantidade de álcool presente em seu corpo é de 10,5 g.
IV - A combustão completa do etanol geral CO e água.
Assinale a alternativa correta.
Levando em consideração o efeito da temperatura e da pressão na solubilidade dos gases em líquido, bem como as reações que ocorrem em meio ácido, pode-se afirmar o seguinte:
CO32-(aq) + 2 H+(aq) → CO2(g) + H2O(ℓ) HCO3-(aq) + H+ (aq) → CO2(g) + H2O(ℓ)
I – O aumento da temperatura e o meio ácido estomacal favorecem a eliminação do CO2. II – A uma temperatura fixa, a solubilidade dos gases diminui com a elevação da pressão. III – Os gases se tornam menos solúveis à medida que a temperatura do líquido no qual estão dissolvidos se reduz. IV – A dissolução de carbonatos e bicarbonatos reduz a acidez do líquido, devido à formação de CO2 e H2O. V – A dissolução de carbonatos e bicarbonatos não interfere no pH do produto, pois não há formação de ácidos nem bases.
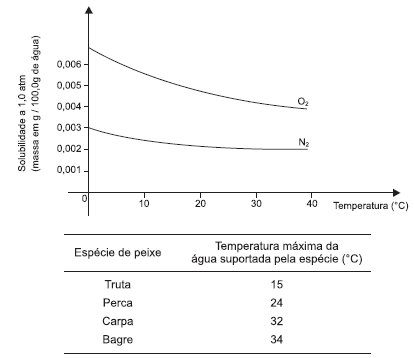
Os gases, de um modo geral, são pouco solúveis em líquidos, embora sua solubilidade dependa consideravelmente da pressão e da temperatura. A vida de animais aquáticos, como algumas espécies de peixe mostrados na tabela, pode ser facilmente afetada por variações de temperatura.
Dessa forma, admitindo-se que a variação de densidade da solução de oxigênio em água é desprezível, a análise do gráfico que representa a curva de solubilidade do oxigênio gasoso em água, em função da temperatura, e das informações da tabela e do texto, permitem corretamente afirmar:
Ao longo dos anos, tem-se tornado cada vez mais necessário aumentar a produtividade agrícola, visando à produção de alimentos. Já nos ambientes urbanos, o controle dos diversos tipos de pragas e insetos é fundamental para a garantia da saúde pública. Para esses fins, passou-se a utilizar, cada vez mais, não só fertilizantes, como também pesticidas, incluindo os inseticidas, herbicidas e fungicidas. Dentre os inseticidas, a Deltametrina é amplamente utilizada no controle de pragas de diversas culturas, no combate de insetos domésticos, dentre outros. O amplo uso da Deltametrina justifica-se por sua potente ação inseticida, toxicidade relativamente baixa em mamíferos e persistência limitada no meio ambiente. Algumas de suas características físicas e químicas estão listadas na tabela abaixo:


COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
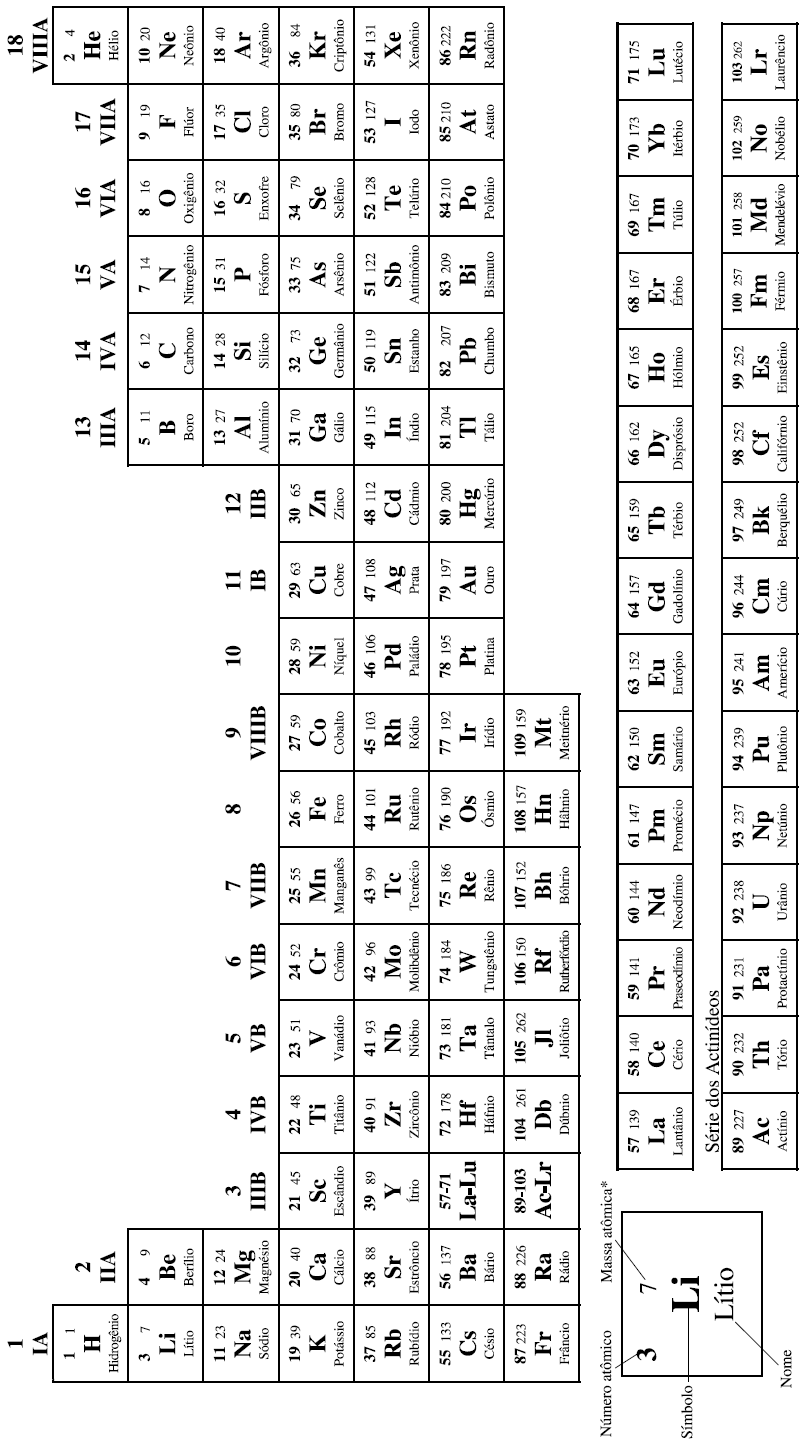
*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE PROCESSO E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao preparar uma solução de Ca(NO3)2 (nitrato de cálcio) em laboratório, um aluno, inadvertidamente, pesou 1,64 g de NH4NO3 (nitrato de amônio) por engano e o dissolveu em água destilada, preparando 1,0 L de solução. Considerando a densidade da água igual a 1,0 g/mL a 25 °C, e dadas as massas molares dos sais,
Ca(NO3)2 = 164 g/mol
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE PROCESSO E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao preparar uma solução de Ca(NO3)2 (nitrato de cálcio) em laboratório, um aluno, inadvertidamente, pesou 1,64 g de NH4NO3 (nitrato de amônio) por engano e o dissolveu em água destilada, preparando 1,0 L de solução. Considerando a densidade da água igual a 1,0 g/mL a 25 °C, e dadas as massas molares dos sais,
Ca(NO3)2 = 164 g/mol
Durante a última parte da viagem, Eduardo pega um pacote contendo 40g de biscoito e lê o rótulo. A tabela que Eduardo vê foi adaptada e está representada a seguir:
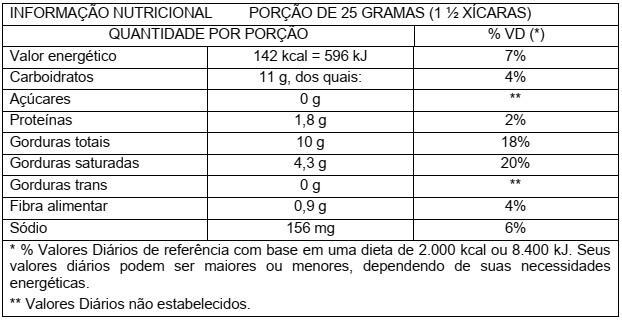
Considere que o total de gordura refere-se apenas a triglicerídeos. Com base nas informações acima, assinale a proposição CORRETA.
Considerando que todo o sódio indicado no rótulo está na forma de cloreto de sódio, pode-se
afirmar que há 140 mg de cloreto na porção indicada.
Durante a última parte da viagem, Eduardo pega um pacote contendo 40g de biscoito e lê o rótulo.
A tabela que Eduardo vê foi adaptada e está representada a seguir:
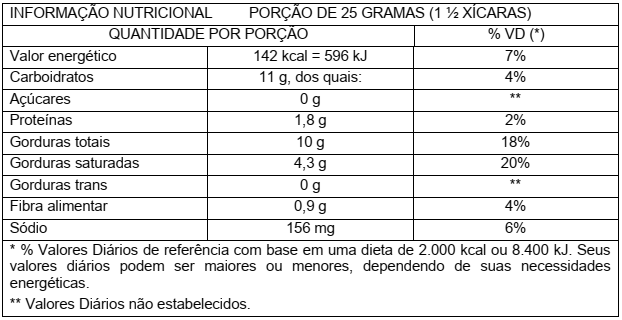
Considere que o total de gordura refere-se apenas a triglicerídeos. Com base nas informações acima, assinale a proposição CORRETA.
Uma porção de 25 gramas contém 5,7 gramas de gordura cis.
Logo no início da viagem os rapazes param para almoçar. Para temperar a salada, eles se deparam com dois tipos de vinagre: um praticamente transparente (comum, com acidez 4%) e outro bastante escuro (balsâmico, com acidez 6%).
Dados sobre a fenolftaleína: incolor, pH<8; rosa, 8<pH<10; roxa, pH>10.
Sobre o assunto, é CORRETO afirmar que:
são necessários 200 mL de uma solução de NaOH 0,5 mol L-1
para neutralizar 100 mL de
vinagre balsâmico.
Logo no início da viagem os rapazes param para almoçar. Para temperar a salada, eles se deparam com dois tipos de vinagre: um praticamente transparente (comum, com acidez 4%) e outro bastante escuro (balsâmico, com acidez 6%).
Dados sobre a fenolftaleína: incolor, pH<8; rosa, 8<pH<10; roxa, pH>10.
Sobre o assunto, é CORRETO afirmar que:
um litro de vinagre comum contém 40 mL de ácido etanoico.
Técnicos realizaram uma inspeção no local, obedecendo às normas de segurança que indicam o tempo máximo de contato com os vapores tóxicos do benzeno. Observe a tabela:
tempo máximo de permanência (h) concentração de benzeno na atmosfera (mg.L-1 ) 2 4 4 3 6 2 8 1
Considerando as normas de segurança, e que a densidade do benzeno líquido é igual a 0,9 g.mL−1 , o tempo máximo, em horas, que os técnicos podem permanecer no interior do galpão, corresponde a:
Suponha que, em alguns dos locais atingidos pela radiação, as pastilhas disponíveis continham, cada uma, 5 x 10−4mol de iodeto de potássio, sendo a dose prescrita por pessoa de 33,2 mg por dia. Em razão disso, cada pastilha teve de ser dissolvida em água, formando 1L de solução.
O volume da solução preparada que cada pessoa deve beber para ingerir a dose diária prescrita de iodeto de potássio corresponde, em mililitros, a:
De acordo com o texto e com os seus conhecimentos, é correto afirmar que:
Fe2+(aq) + HCO-3 + O2(aq) → Fe2O3(s) + CO2(g) + H2O(l)
A presença de sais de ferro, a exemplo de bicarbonato de ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa manchas de cor marrom quando a água goteja sobre a superfície de azulejos, pisos e vasos sanitários, em razão da formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:
As curvas de solubilidade têm grande importância no estudo das soluções de sólidos em líquidos, porque a temperatura é o único fator físico perceptível que influi na solubilidade. Há certas substâncias químicas cujas curvas de solubilidade apresentam pontos de inflexão que denotam mudanças de estrutura do soluto, como é possível verificar no gráfico da solubilidade do sulfato de sódio decaidratado, Na2SO4.10H2O.
A análise desse gráfico permite corretamente afirmar: