Questões de Vestibular
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 306 questões
Leia o enunciado abaixo, sobre as órbitas eletrônicas.
“As órbitas eletrônicas em torno dos núcleos atômicos devem conter um número inteiro N de comprimentos de onda de de Broglie do elétron.”
Considere as seguintes afirmações sobre o enunciado acima.
I - Ele evidencia o comportamento onda-partícula do elétron.
II - Ele assegura que as órbitas eletrônicas são sempre circunferenciais.
III- Ele define o número quântico N que identifica a órbita ocupada pelo elétron.
Quais estão corretas?
Os filmes de super-heróis dos quadrinhos se tornaram um fenômeno do cinema nos últimos anos. Um exemplo é o Homem de Ferro, personagem fictício dos quadrinhos publicados pela Marvel Comics. Sua identidade verdadeira é a do empresário e bilionário Tony Stark, que usa armaduras de alta tecnologia no combate ao crime.
Seu traje é feito de titânio (22Ti48), reforçado com fibra de carbono e revestimento cerâmico (usado em coletes à prova de balas e blindagem de carros). Já o capacete é hermeticamente selado, não permitindo, por isso, contaminação por fumaça ou venenos. A viseira é retrátil e um processador ligado à cabeça capta os sinais do cérebro, interpreta as ordens e as repassa para o traje. Instalado no peito do herói, um reator realiza a fusão fria do elemento paládio (46Pd106) para gerar a energia que alimenta as partes-chaves do traje. Além disso, ele também é capaz de disparar raios de energia.

(Fonte: https://www.pinterest.pt/jucianim/desenho/?lp=true Acesso em jan. 2018.)
Em relação aos elementos químicos constituintes do traje do
Homem de Ferro,
Diferentes métodos são utilizados por profissionais da área de Ciência Forense para determinar a quanto tempo o indivíduo veio a óbito. Pesquisadores brasileiros reportaram que existe uma relação linear entre a concentração de Fe2+ no corpo vítreo do olho com o intervalo pós-morte. Este método é baseado em uma reação de Fe2+ com orto-fenantrolina como agente cromogênico realizada em um dispositivo de papel, cujo produto da reação apresenta coloração alaranjada. Desta forma, quanto maior o tempo de intervalo pós-morte maior a intensidade de coloração do produto.
(Adaptado de: GARCIA, P.T.; GABRIEL, E.F.M.; PESSÔA, G.S.; SANTOS JUNIOR, J.C.; MOLLO FILHO, P. C.; GUIDUGLI, R.B.F.; HÖEHR, N.F.; ARRUDA, M.A.Z.; COLTRO, W.K.T, Analytica Chimica Acta, v. 974, n.29, p.69-74, 2017).
A equação química da reação de Fe2+ com orto-fenantrolina é apresentada na figura seguir.
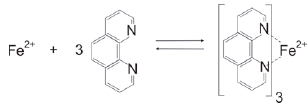
Considerando os conceitos, as definições de ácido e base e a reação química apresentada, assinale a alternativa correta.
Dois grandes grupos de substâncias compõem as células, as substâncias orgânicas e as inorgânicas, sendo as inorgânicas representadas pela água e pelos sais minerais. Os sais minerais atuam no corpo humano na contração muscular, coagulação sanguínea, síntese de proteínas etc. Entre os elementos que são importantes nos sais minerais, podemos citar, 20Ca, 11Na, 12Mg, 26Fe, 30Zn, 24Cr e 25Mn.
Considerando os elementos acima, assinale a alternativa correta.
Analise o Quadro que apresenta o número de prótons, elétrons e nêutrons de quatro espécies químicas.
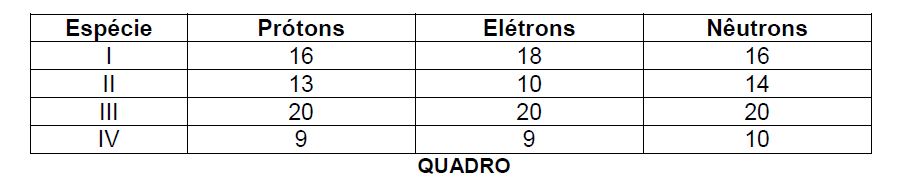
Considerando os dados apresentados no Quadro e de acordo com a Tabela Periódica, assinale
a alternativa incorreta.
Em seu ciclo, um átomo de carbono pode ser incorporado a diferentes compostos por meio de processos contínuos de decomposição e formação de novas moléculas. Os átomos de carbono deste caderno de prova, por exemplo, serão degradados ao longo do tempo e, posteriormente, incorporados a outros seres vivos.
Considere que, ao se degradarem, os átomos de carbono deste caderno se distribuam igualmente entre os 7,5 bilhões de habitantes do planeta.
Sabendo que o caderno possui 90 g de massa, com 45% de carbono em sua composição, o número de átomos que será incorporado em cada habitante é igual a:
Considere a figura abaixo.
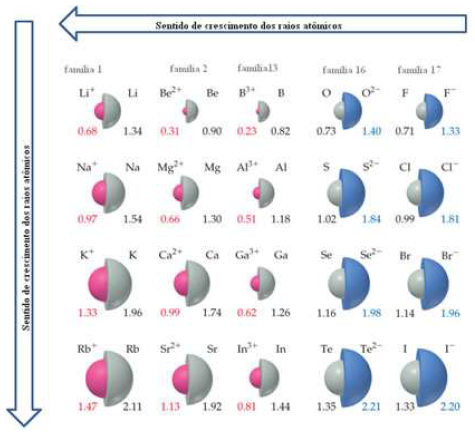
Disponível em: <http://mundoeducacao.bol.uol.com.br/upload/conteudo/crescimento-dos-raiosatomicos-na-tabela.jpg>. Acesso em 11 de março 2018.
Essa figura representa os raios atômicos e iônicos de algumas espécies químicas.
Sobre essas espécies e seus raios, é correto concluir que
Recentemente, cientistas conseguiram produzir hidrogênio metálico, comprimindo hidrogênio molecular sob elevada pressão. As propriedades metálicas desse elemento são as mesmas dos demais elementos do grupo 1 da tabela de classificação periódica.
Essa semelhança está relacionada com o subnível mais energético desses elementos, que corresponde a:
Dos extensos efeitos nocivos que a radiação ionizante provoca na matéria viva, afigura-se a geração de radicais livres, que são espécies químicas eletricamente neutras que apresentam um ou mais elétrons desemparelhados na camada de valência. O íon cloreto, por exemplo, que, quantitativamente, constitui o principal ânion do plasma, transforma-se no radical livre Cℓ●, com 7 elétrons na camada de valência, podendo, assim, reagir facilmente com as biomoléculas, alterando o comportamento bioquímico de muitas proteínas solúveis do meio sanguíneo e também os constituintes membranários de células: hemácias, leucócitos, plaquetas.
(José Luiz Signorini e Sérgio Luís Signorini. Atividade física e radicais livres, 1993. Adaptado.)
Ao transformar-se em radical livre, o ânion cloreto
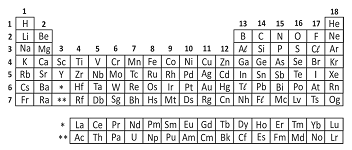
Analise a tabela periódica e as seguintes afirmações a respeito do elemento químico enxofre (S):
I. Tem massa atômica maior do que a do selênio (Se).
II. Pode formar com o hidrogênio um composto molecular de fórmula H2S.
III. A energia necessária para remover um elétron da camada mais externa do enxofre é maior do que para o sódio (Na).
IV. Pode formar com o sódio (Na) um composto iônico de fórmula Na3S.
São corretas apenas as afirmações
Na Onda do Sódio
Eu sou o Sódio,
não tenho ódio.
Quando estou com a água,
não guardo mágoa.
Explodo de emoção,
nessa reação.
Não esbanjo meu potencial,
sou muito legal.
Minha família é a um,
me dou bem com cada um.
Meu período é o terceiro,
de quem eu sou parceiro.
Existe um halogênio especial,
me ligo a todos, mas com o cloro...
Eu adoro!
Que união genial!
Me envolvo em muitas reações,
com diferentes emoções.
Base, cátion, sal...
Eu sou mesmo radical!
(Poesia de autoria de equipe participante da Gincana de Química (2011) da
Universidade Federal do Ceará. Disponível em:<http://www.quimica.ufc.br>
Acerca das informações químicas do elemento sódio que podem ser extraídas do texto “Na onda do sódio”, considere as seguintes afirmativas:
1. Da afirmativa “Minha família é a um”, pode-se concluir que sódio pertence à família I e, portanto, possui configuração eletrônica finalizada em ns1 .
2. Da afirmativa “Meu período é o terceiro”, interpreta-se que a configuração eletrônica é preenchida até o nível n = 3.
3. O cloro é o “halogênio especial”, pois é com o qual o sódio reage para formar o cloreto de sódio.
4. No sal de cloreto de sódio, a configuração eletrônica do cátion Na+ é preenchida até o nível n = 2, finalizando em 2s2 , 2p6 .
Assinale a alternativa correta.
A descoberta dos isótopos foi de grande importância para o conhecimento da estrutura atômica da matéria.
Sabe-se, hoje, que os isótopos 54Fe e 56Fe têm, respectivamente, 28 e 30 nêutrons.
A razão entre as cargas elétricas dos núcleos dos isótopos 54Fe e 56Fe é igual a:


