Questões de Vestibular
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 305 questões
Na notícia “Nova Iorque planeja liderança em reciclagem”, do site da Science American Brasil, há importantes referências ao sofisticado sistema de separação dos materiais presentes no lixo dessa cidade.
“A primeira coisa que a usina do Brooklyn fará é rasgar e remover as sacolas plásticas que tantos nova-iorquinos usam para empacotar seus recicláveis. O vidro será moído, separado e transportado pelo Porto de Nova York até Nova Jersey, onde ele passará por uma nova máquina de raios-x para ser novamente separado; contaminantes como boro e vidro com chumbo também serão removidos. De volta ao Brooklyn, outros recicláveis passam por uma correia transportadora enquanto ímãs extraem metais ferrosos.
O plástico e o alumínio restantes são passados por correntes de Foucault, que extraem o alumínio.”
TWEED, Katherine. Nova Iorque planeja liderança em reciclagem. Scientifi c American Brasil.
(http://www2.uol.com.br/sciam/noticias/nova_iorque_ planeja_lideranca_em_reciclagem.html).
Sobre os materiais citados no texto, é correto afirmar
que
Água coletada em Fukushima em 2013 revela radioatividade recorde
A empresa responsável pela operação da usina nuclear de Fukushima, Tokyo Electric Power (Tepco), informou que as amostras de água coletadas na central em julho de 2013 continham um nível recorde de radioatividade, cinco vezes maior que o detectado originalmente. A Tepco explicou que uma nova medição revelou que o líquido, coletado de um poço de observação entre os reatores 1 e 2 da fábrica, continha nível recorde do isótopo radioativo estrôncio-90.
(www.folha.uol.com.br. Adaptado.)
O estrôncio, por apresentar comportamento químico semelhante ao do cálcio, pode substituir este nos dentes e nos ossos dos seres humanos. No caso do isótopo Sr-90, radioativo, essa substituição pode ser prejudicial à saúde. Considere os números atômicos do Sr = 38 e do Ca = 20. É correto afirmar que a semelhança de comportamento químico entre o cálcio e o estrôncio ocorre porque
Água coletada em Fukushima em 2013 revela radioatividade recorde
A empresa responsável pela operação da usina nuclear de Fukushima, Tokyo Electric Power (Tepco), informou que as amostras de água coletadas na central em julho de 2013 continham um nível recorde de radioatividade, cinco vezes maior que o detectado originalmente. A Tepco explicou que uma nova medição revelou que o líquido, coletado de um poço de observação entre os reatores 1 e 2 da fábrica, continha nível recorde do isótopo radioativo estrôncio-90.
(www.folha.uol.com.br. Adaptado.)
O estrôncio-90, 9038Sr, é o principal isótopo desse elemento químico encontrado nos reatores nucleares. Sobre esse isótopo,é correto afirmar que seu cátion bivalente possui
No ano de 2014, o Estado de São Paulo vive uma das maiores crises hídricas de sua história. A fim de elevar o nível de água de seus reservatórios, a Companhia de Saneamento Básico do Estado de São Paulo (Sabesp) contratou a empresa ModClima para promover a indução de chuvas artificiais. A técnica de indução adotada, chamada de bombardeamento de nuvens ou semeadura ou, ainda, nucleação artificial, consiste no lançamento em nuvens de substâncias aglutinadoras que ajudam a formar gotas de água.
(http://exame.abril.com.br. Adaptado.)
Uma das substâncias aglutinadoras que pode ser utilizada para a nucleação artificial de nuvens é o sal iodeto de prata, de fórmula AgI. Utilizando os dados fornecidos na Classificação Periódica dos Elementos, é correto afirmar que o cátion e o ânion do iodeto de prata possuem, respectivamente,

Desde a década de 70, não há comercialização do minério bruto ou do concentrado de nióbio (pirocloro) no mercado interno ou externo. O metal é vendido, sobretudo, na forma da liga ferro-nióbio (FeNb STD, com 66% de teor de nióbio e 30% de ferro), obtida a partir de diversas etapas de processamento. Segundo o governo, as exportações de ferro-liga de nióbio atingiram em 2012 aproximadamente 71 mil toneladas, no valor de US$ 1,8 bilhão.
(http://g1.globo.com. Adaptado.)
A Classificação Periódica dos Elementos é importante ferramenta dos químicos. Sobre esse assunto, são feitas as seguintes afirmativas:
I. Os elementos prata e chumbo apresentam, respectivamente, massa atômica aproximada de 108 e 207.
II. Com exceção do hidrogênio, os elementos da extremidade esquerda da tabela periódica são metais de transição.
III. Na tabela periódica atual, os elementos são organizados em função do seu número atômico.
IV. Em geral, elementos representativos de mesmo grupo da tabela periódica apresentam massas atômicas similares.
São corretas somente as afirmativas
Sobre os compostos de cálcio, assinale a afirmativa INCORRETA.

Alimentos como ovos, leite, manteiga e cacau fornecem ao organismo uma substância chamada ergosterol. Na presença de raios solares, nosso organismo transforma ergosterol em vitamina D. Essa vitamina favorece a retenção de Cálcio e de Fósforo nos ossos e nos dentes (REIS, Martha. Completamente Química: Vol. 1. São Paulo: FTD, 2001. p. 390). Dado que a massa molar do ergosterol e da vitamina D (calciferol) são 396,6 g mol–1 e 384,6 g mol–1, respectivamente, assinale o que for correto.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
O urânio 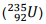 é um elemento químico radioativo utilizado na construção da bomba atômica lançada na cidade
de Hiroshima, no Japão, durante a Segunda Guerra Mundial. O átomo de urânio apresenta:
é um elemento químico radioativo utilizado na construção da bomba atômica lançada na cidade
de Hiroshima, no Japão, durante a Segunda Guerra Mundial. O átomo de urânio apresenta:

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
Os raios iônicos variam da sequência Na+> Mg2+> Al3+.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
A eletroafinidade do átomo de potássio é maior que a do átomo de cloro.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
A distribuição eletrônica do átomo do tungstênio apresenta elétrons mais energéticos no subnível 5d e
elétrons mais externos no subnível 6s.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
No processo de ionização, um átomo neutro recebe um elétron, liberando energia.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
A carga nuclear efetiva Zef experimentada pelo elétron é sempre maior que a carga nuclear nominal.

O teste de chamas é um experimento realizado principalmente ao se estudar o conceito do
modelo atômico de Rutherford-Böhr.
Com base nos conhecimentos sobre estrutura atômica e propriedades periódicas, é correto afirmar:
Isótopos são átomos com o mesmo número de massa.