Questões de Vestibular
Sobre teoria atômica: átomos e sua estrutura - número atômico, número de massa, isótopos, massa atômica em química
Foram encontradas 306 questões
Segundo pesquisas recentes, há uma bactéria que parece ser capaz de substituir o fósforo por arsênio em seu DNA.
Uma semelhança entre as estruturas atômicas desses elementos químicos que possibilita essa substituição é:
Existem quatro números quânticos: número quântico principal; número quântico de momento angular ou azimutal (secundário); número quântico magnético e número quântico de spin. Esses quatro números quânticos, além de se complementarem, nos permitem fazer uma descrição completa dos elétrons nos átomos, pois eles representam o nível principal de energia do elétron, o subnível de energia, a orientação espacial da nuvem eletrônica e a orientação do próprio elétron na nuvem.
Considerando as informações, dentre as seguintes séries de números quânticos abaixo, aquela que descreve corretamente um elétron em um dado átomo é:
TEXTO 3
O acendedor de lampiões
Lá vem o acendedor de lampiões da rua!
Este mesmo que vem infatigavelmente,
Parodiar o sol e associar-se à lua
Quando a sombra da noite enegrece o poente!
Um, dois, três lampiões, acende e continua
Outros mais a acender imperturbavelmente,
À medida que a noite aos poucos se acentua
E a palidez da lua apenas se pressente.
Triste ironia atroz que o senso humano irrita: —
Ele que doura a noite e ilumina a cidade,
Talvez não tenha luz na choupana em que habita.
Tanta gente também nos outros insinua
Crenças, religiões, amor, felicidade,
Como este acendedor de lampiões da rua!
(LIMA, Jorge de. Melhores poemas. 3. ed. São Paulo: Global, 2006. p. 25)
O Texto 3 faz referência à iluminação, elemento fundamental na vida das pessoas. Dos lampiões a querosene ao LED, tem-se uma ideia de como a evolução da iluminação contribuiu para a transformação das cidades e dos hábitos das pessoas. Essa evolução vai da utilização do óleo ao querosene, deste ao gás, chegando finalmente à energia elétrica. Foi apenas no século XX que a eletricidade passou a ser popularmente usada na iluminação das ruas. Vários tipos de lâmpadas foram utilizadas em iluminação pública: incandescente, halógena, fluorescente linear, lâmpada mista, lâmpada a vapor de mercúrio, lâmpada a vapor de sódio de alta pressão. A tecnologia é desenvolvida, aplicada e melhorada. Atualmente, além da eficiência e economia, o light emitter diode ou LED é a tecnologia que permite melhor relação com o meio ambiente, porque não utiliza mercúrio, que é tóxico.
(Adaptado de CODI - Comitê de Distribuição - Substituição de lâmpadas incandescentes no sistema de iluminação pública - Relatório SCPE.33.01 de 13 out. 1988. Comitê de Distribuição (CODI), Abradee, Rio de Janeiro, 1988.)
O LED é um componente eletrônico semicondutor que transforma energia elétrica em luz. Essa transformação é diferente daquela encontrada nas lâmpadas convencionais, que utilizam filamentos metálicos, radiação ultravioleta e descarga de gases. No arsenieto de gálio
ou no fosfeto de gálio, por exemplo, ocorre a eletroluminescência,
que é a emissão de luz com aplicação de uma
fonte elétrica.
I-No estado fundamental, o átomo de arsênio apresenta um orbital completo na camada de valência.
II-Fósforo e arsênio apresentam cinco camadas de energia em sua distribuição eletrônica, no estado fundamental, pois estão localizados no mesmo período da tabela periódica.
III-Apenas os elétrons da camada de valência do gá- lio em seu estado fundamental apresentam valores idênticos para todos os números quânticos – principal, secundário, magnético e spin.
IV-No LED, a maior parte da energia absorvida é dissipada na forma de calor.
É(são) correto(s) apenas o(s) item(ns):
Dado: 1 pm equivale a 10-12m
O raio covalente de um átomo corresponde à distância entre o núcleo atômico e a camada de valência. O comprimento de ligação é, aproximadamente, a soma dos raios covalentes dos átomos envolvidos

Na fórmula estrutural do ácido acético, encontramos ligações C-H, O-H, C-O, C=O e C-C.
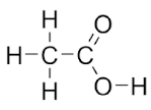
Considerando a distribuição eletrônica e o número
atômico de cada átomo, a alternativa que apresenta
valores coerentes para os comprimentos de ligação
presentes na molécula de ácido acético é
Os elementos cloro (Z = 17) e iodo (Z = 53) pertencem ao mesmo grupo da tabela periódica. Assim, átomos neutros desses elementos apresentam igual
I. número de prótons;
II. número de elétrons na camada de valência;
III. eletronegatividade.
É correto o que se afirma em
A medicina tem desenvolvido diversos tratamentos para pacientes com câncer de cérebro. Em um deles, o paciente ingere o composto borofenilalanina. Essa molécula que contém o isótopo boro-10 tem afinidade pelas células cerebrais. Após a ingestão, o paciente é submetido a um feixe de nêutrons. Cada isótopo de boro-10 captura um nêutron e forma um isótopo instável que se fissiona em duas espécies menores e emite ainda radiação gama. Dessa maneira, a célula tumoral é atingida pela energia das emissões do processo de fissão e é destruída.
(www.nipe.unicamp.br/enumas/admin/resources/uploads/robertovicente_hasoluçao.pdf.Adaptado)
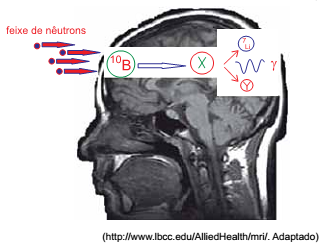
O isótopo instável, representado por X, e a espécie emitida
na fissão, representada por Y, são, respectivamente,
Leia o texto e examine a tabela para responder à questão.
O ano de 2015 foi eleito como o Ano Internacional da Luz, devido à importância da luz para o Universo e para a humanidade. A iluminação artificial, que garantiu a iluminação noturna, impactou diretamente a qualidade de vida do homem e o desenvolvimento da civilização. A geração de luz em uma lâmpada incandescente se deve ao aquecimento de seu filamento de tungstênio provocado pela passagem de corrente elétrica, envolvendo temperaturas ao redor de 3000 °C.
Algumas informações e propriedades do isótopo estável do tungstênio estão apresentadas na tabela.
Símbolo W
Número atômico 74
Número de massa 184
Ponto de fusão 3422 °C
Eletronegatividade (Pauling) 2,36
Densidade 19,3 g· cm–3
Disponível em:<http://info.abril.com.br/noticias/ciencia/2015/07mit-1.shtml> . Acesso em: 20 ago. 15. (Adaptado.)
Em relação ao nióbio, analise as proposições a seguir, quanto à sua veracidade (V) ou falsidade (F).
( ) O elemento químico nióbio é um metal de transição interna do quarto período da Tabela Periódica.
( ) Átomos de nióbio, no estado fundamental, apresentam 5 elétrons na camada de valência.
( ) O elétron de maior energia de um átomo de nióbio, no estado fundamental, encontra-se no subnível 4s.
( ) A liga ferro-nióbio é um exemplo de solução sólida, onde os átomos de ferro e de nióbio estão unidos entre si por meio de ligações metálicas.
Assinale a alternativa que preenche correta e respectivamente os parênteses, de cima para baixo.
TEXTO 7
Memórias de um pesquisador
Não era bem vida, era uma modorra – mas de qualquer modo suportável e até agradável. Terminou bruscamente, porém, eu estando com vinte e oito anos e um pequeno bujão de gás explodindo mesmo à minha frente, no laboratório de eletrônica em que trabalhava, como auxiliar. Me levaram às pressas para o hospital, os médicos duvidando que eu escapasse. Escapei, mas não sem danos. Perdi todos os dedos da mão esquerda e três (sobraram o polegar e o mínimo) da direita. Além disso fiquei com o rosto seriamente queimado. Eu já não era bonito antes, mas o resultado final – mesmo depois das operações plásticas – não era agradável de se olhar. Deus, não era nada agradável.
No entanto, nos primeiros meses após o acidente eu não via motivos para estar triste. Aposentei-me com um bom salário. Minha velha tia, com quem eu morava, desvelava-se em cuidados. Preparava os pastéis de que eu mais gostava, cortava-os em pedacinhos que introduzia em minha boca – derramando sentidas lágrimas cuja razão, francamente, eu não percebia. Deves chorar por meu pai – eu dizia – que está morto, por minha mãe que está morta, por meu irmão mais velho que está morto; mas choras por mim. Por quê? Escapei com vida de uma explosão que teria liquidado qualquer um; não preciso mais trabalhar; cuidas de mim com desvelo; de que devo me queixar?
Cedo descobri. Ao visitar certa modista.
Esta senhora, uma viúva recatada mas ardente, me recebia todos os sábados, dia em que os filhos estavam fora. Quando me senti suficientemente forte telefonei explicando minha prolongada ausência e marcamos um encontro.
Ao me ver ficou, como era de se esperar, consternada. Vais te acostumar, eu disse, e propus irmos para a cama. Me amava, e concordou. Logo me deparei com uma dificuldade: o coto (assim eu chamava o que tinha me sobrado da mão esquerda) e a pinça (os dois dedos restantes da direita) não me forneciam o necessário apoio. O coto, particularmente, tinha uma certa tendência a resvalar pelo corpo coberto de suor da pobre mulher. Seus olhos se arregalavam; quanto mais apavorada ficava, mais suava e mais o coto escorregava.
Sou engenhoso. Trabalhando com técnicos e cientistas aprendi muita coisa, de modo que logo resolvi o problema: com uma tesoura, fiz duas incisões no colchão. Ali ancorei coto e pinça. Pude assim amá-la, e bem.
– Não aguentava mais – confessei, depois. – Seis meses no seco!
Não me respondeu. Chorava. – Vais me perdoar, Armando – disse – eu gosto de ti, eu te amo, mas não suporto te ver assim. Peço-te, amor, que não me procures mais.
– E quem vai me atender daqui por diante? – perguntei, ultrajado.
Mas ela já estava chorando de novo. Levantei-me e saí. Não foi nessa ocasião, contudo, que fiquei deprimido. Foi mais tarde; exatamente uma semana depois.
[...]
(SCLIAR, Moacyr. Melhores contos. Seleção de
Regina Zilbermann. São Paulo: Global, 2003. p.
176-177.)
A pólvora, usada como explosivo desde tempos remotos, é uma mistura de nitrato de potássio, enxofre e carvão. Com a explosão, ocorre formação de sulfato de potássio, dióxido de carbono e nitrogênio molecular.
Sobre essa explicação acerca da explosão, assinale a única afirmação correta:
TEXTO 5
NA VIRADA DO SÉCULO, o biólogo Roosmarc conheceu o ápice da fama ao descobrir um novo gênero de primata: o sagui-anão-de-coroa-preta. Foi considerado pela revista Time o grande herói do planeta. Entre os mais de 500 primatas no mundo, Roosmarc descobrira o Callibella humilis, o macaquinho mais saltitante e alegre, anãozinho, com aquela coroa preta. Enquanto outros primatólogos matavam os animais para descrevê-los, dissecando-os em laboratórios, longe da Amazônia, ele criava macacos em sua casa. Esperava que morressem de forma natural e, aí sim, dissecava-os.
O sagui-anão-de-coroa-preta foi a sensação mundial. Então, ele viveu o ápice da glória. As publicações científicas não se cansaram de elogiá-lo. Quase todos os dias, jornais e revistas estampavam: “Protetor dos animais”, “O bandeirantes da Amazônia”, “O último primatólogo”. De Manaus para o mundo. Os ribeirinhos o saudavam; os políticos o pajeavam; os estudantes de biologia o veneravam. Sim, Roosmarc era visto e considerado como herói do planeta.
Vida simples, com suas vestes quase sempre largas cobrindo o corpo magro e alto, enfiado semanas na floresta, nunca quisera dinheiro, jamais almejara fortuna. O verdadeiro cientista, dizia, quer, antes de tudo, reconhecimento. Não havia prêmio maior do que isso. Sequer gastava o que ganhava. Aprendera com os bichos que, na vida, não se precisa de muitas coisas...
Nascera no sul da Holanda e, aos 17 anos, mudou-se para Amsterdã. Queria estudar biologia. Nos fins do ano 60, a cidade fervilhava, era a capital da contestação. John Lennon e Yoko Ono haviam escolhido a cidade para protestar contra a Guerra do Vietnã. Os rebeldes desfilavam pelas ruas, enquanto John Lennon e Yoko Ono incitavam a quebra de valores deitados uma semana num hotel da cidade, consumindo droga e criando suas canções. O gosto pela contracultura crescia, agigantava-se. Rebelde, Roosmarc desfilava pelas ruas, gritando pela paz, também queimando maconha e outras ervas.
Mas foi, nesta época, que ele se interessou pelos primatas. Depois que terminou a universidade, fez amizade com uma estudante, que também saboreava a contracultura, o desprezo a normas e procedimentos, e com ela, vivendo um romance apaixonado, deu volta ao mundo, como se fosse o famigerado navegante português Vasco da Gama. Estudante de artes plásticas, Marie tinha sede por aventuras: o novo lhe apetecia; o velho não era mais do que um mundo cinzento. A Europa, com seus prédios cinzentos e frios, uma população resignada, não lhe apetecia. Queria quebrar barreiras, outras fronteiras. Não queria apodrecer naquelas cidadezinhas holandesas, onde as mulheres envelheciam rapidamente e só cuidavam de casa. Não queria se transformar num símbolo de cama, fogão e igreja. Menosprezava o título “rainha do lar”, que os pastores tanto veneravam entre a população fiel. Tinha horror ao ver sua mãe de lenço na cabeça e avental cobrindo a gordura da barriga. Se ficasse numa daquelas cidadezinhas, em poucos anos estaria como a mãe – brigava constantemente com o seu pai, saía de casa aos domingos para assistir a mesmice do partor Simeão, e que, rapidamente, voltava para casa para preparar o almoço para os filhos. Que destino! A liberdade a chamava. Não era o que dizia a canção de John Lennon? Ao conhecer Roosmarc, o desejo por aventuras avivou como brasa viva. Quando convidada para segui-lo, e ela queria produzir desenhos e aquarelas jamais vistas no mundo, não titubeou, como se a oportunidade fosse um cavalo encilhado. E cavalo encilhado passa por nós somente uma vez ...
(GONÇALVES, David. Sangue verde. Joinville: Sucesso Pocket, 2014. p. 200-201.Adaptado.)
Beck, fino, banza, cano do diabo ou simplesmente baseado são exemplos de gírias usadas para designar um cigarro de maconha. Preparado de forma manual, um desses cigarros pode conter até um grama de maconha, quantidade suficiente para fazer muita fumaça. A maconha é produzida a partir da folha da Cannabis sativa. Como toda planta, ela é constituída de várias substâncias. Dentre elas, temos o canabidiol (C21H30O2 , de massa molar = 314,45g/mol), que pode chegar a quase 40% do extrato vegetal. O canabidiol apresenta baixa toxicidade em seres humanos e em outras espécies: a LD50 (quantidade de ingrediente ativo de uma substância tóxica necessária para matar 50% de animais testados) após a administração intravenosa em macacos foi de 212 mg/kg (SCUDERI et al., 2008).
(SCUDERI, Caterina et al. Cannabidiol in Medicine: a review of its therapeutic potential in CNS
Disorders. Phytotherapy research, n.23, p. 597-602. 9 Oct. 2008.)
Assinale a única alternativa correta com relação ao exposto anteriormente:


Considere as seguintes afirmações:
I. A aparência macroscópica do fleróvio é desconhecida, mas, provavelmente, será a de um sólido metálico.
II. Na formação do fleróvio-288, por processo análogo ao da síntese do fleróvio-289, são liberados 3 prótons.
III. No grupo da tabela periódica ao qual pertence o fleróvio, há elementos que formam óxidos covalentes.
É correto o que se afirma apenas em
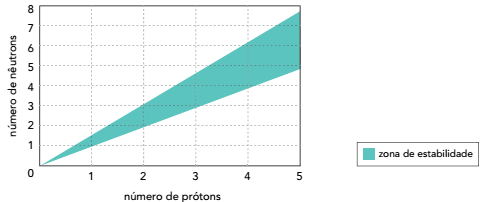
São considerados estáveis os átomos cuja interseção entre o número de prótons e o de nêutrons se encontra dentro da zona de estabilidade mostrada no gráfico.
Verifica-se, com base no diagrama, que o menor número de massa de um isótopo estável de um metal é igual a:

A prata é um metal que apresenta excelente ductilidade e a maior condutividade elétrica dentre todos os elementos químicos.
Um fio de prata possui 10 m de comprimento (l) e área de secção transversal (A) de 2,0 × 10–7 m2.

O oxigênio é encontrado na natureza sob a forma de três átomos: 16O, 17O e 18O. No estado fundamental, esses átomos possuem entre si quantidades iguais de duas das grandezas apresentadas.
Os símbolos dessas duas grandezas são:
Com as informações que podem ser obtidas da tabela periódica, relacione os elementos apresentados na coluna da esquerda com a informação da coluna à direita que indica a respectiva distribuição dos elétrons nos subníveis do último nível de energia ocupado no estado fundamental.
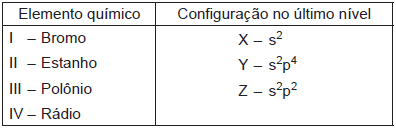
Estão corretas as associações:
Para representarem corretamente o modelo da molécula do C4H8O2, as bolas de plástico tinham tamanhos diferentes (pequenas, médias e grandes). Suas massas, em gramas, eram iguais aos valores das massas molares dos elementos C, H e O. Em escala ampliada para centímetros, seus raios tinham a mesma ordem de tamanho dos raios atômicos dos átomos que representavam.
Sobre essas bolas de plástico que representam as características de tamanho e massa dos átomos de C, H e O, os alunos concluíram:
I. as bolas que representam os átomos de H eram as pequenas, e as que representam os átomos de O eram as grandes;
II. a massa total das bolas grandes correspondia a seis vezes a massa total das bolas de tamanho pequeno;
III. a massa total das bolas pequenas correspondia a ¼ da massa total das bolas de tamanho médio.
Classificando cada uma das conclusões como verdadeira (V) ou falsa (F), tem-se, correta e respectivamente: