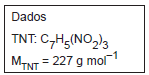Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 343 questões
Sob certas condições, tanto o gás flúor quanto o gás cloro podem reagir com hidrogênio gasoso, formando,respectivamente, os haletos de hidrogênio HF e HCl, gasosos. Pode-se estimar a variação de entalpia (ΔH) de cada uma dessas reações, utilizando-se dados de energia deligação. A tabela apresenta os valores de energia de ligação dos reagentes e produtos dessas reações a 25 ºC e 1 atm.

Com base nesses dados, um estudante calculou a variação de entalpia (ΔH) de cada uma das reações e concluiu,corretamente, que, nas condições empregadas.
No início do século XX, Pierre Curie e colaboradores, em uma
experiência para determinar características do recém-descoberto elemento químico rádio, colocaram uma
pequena quantidade desse material em um calorímetro e
verificaram que 1,30 grama de água líquida ia do ponto de
congelamento ao ponto de ebulição em uma hora. A
potência média liberada pelo rádio nesse período de tempo
foi, aproximadamente,
Note e adote:
Calor específico da água: 1 cal/(g ºC)
1 cal = 4 J
Temperatura de congelamento da água: 0 ºC
Temperatura de ebulição da água: 100 ºC
Considere que toda a energia emitida pelo rádio foi absorvida pela água
e empregada exclusivamente para elevar sua temperatura.
Dado:

A reação de hidrogenação do etileno ocorre com aquecimento, na presença de níquel em pó como catalisador. A equação termoquímica que representa o processo é
C2 H4 (g) + H2 (g) → C2 H6 (g) ΔHθ = - 137 kJ.mol-1