Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
Desenvolveu-se, recentemente, uma bateria com uma grande capacidade de carga e número de ciclos, além de rapidez de recarga. Simplificadamente, no funcionamento dessa bateria ocorre uma deposição de lítio metálico num eletrodo de estanho e carbono (Sn/C), enquanto num eletrodo de carbono e sulfeto de lítio (Li2S/C) liberam-se o íon lítio e o enxofre elementar. Considerando essas informações, pode-se afirmar que no funcionamento da bateria ocorre
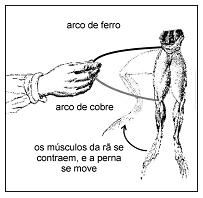
Interpretando essa observação com os conhecimentos atuais, pode-se dizer que as pernas da rã continham soluções diluídas de sais. Pode-se, também, fazer uma analogia entre o fenômeno observado e o funcionamento de uma pilha.
Considerando essas informações, foram feitas as seguintes afirmações:
I. Devido à diferença de potencial entre os dois metais, que estão em contato entre si e em contato com a solução salina da perna da rã, surge uma corrente elétrica.
II. Nos metais, a corrente elétrica consiste em um fluxo de elétrons.
III. Nos músculos da rã, há um fluxo de íons associado ao movimento de contração.
Está correto o que se afirma em
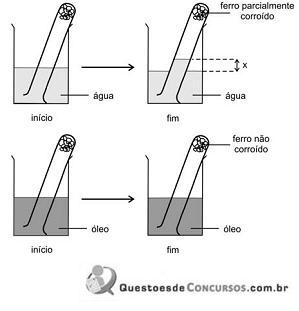
Sobre tal experimento, considere as seguintes afirmações:
I. Com base na variação (x) de altura da coluna de água dentro do primeiro tubo de ensaio, é possível estimar a porcentagem de oxigênio no ar.
II. Se o experimento for repetido com massa maior de fios de ferro, a diferença entre o nível da água no primeiro tubo e no recipiente será maior que x.
III. O segundo tubo foi mergulhado no recipiente com óleo a fim de avaliar a influência da água no processo de corrosão.
Está correto o que se afirma em

Essa última transformação
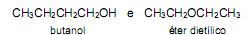
Certas propriedades de cada uma dessas substâncias dependem das interações entre as moléculas que a compõem (como, por exemplo, as ligações de hidrogênio). Assim, pode-se concluir que,
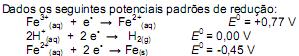
Assinale a alternativa correspondente à equação química correta e referente à reação que deverá ocorrer espontaneamente:
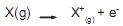
Esse é um processo endotérmico, porque o elétron é atraído pelo núcleo positivo, portanto, deve-se fornecer energia para removê-lo. Uma vez que todos os átomos, exceto o hidrogênio, possuem mais do que um elétron, eles também possuem mais de um potencial de ionização. Considerando essa informação, escolha a alternativa que apresenta o átomo com maior potencial de ionização dentre os pares abaixo:
(1) B ou C; (2) O ou Si; (3) Cl ou As.

Sobre essa reação, marque a afirmativa verdadeira.
Ca10(PO4)6OH2(s)+H+ (aq) ↔Ca2+ (aq)+HPO4 2– (aq)+ H2O(l)
A reação direta, que enfraquece o esmalte e produz a cárie, é conhecida como desmineralização, e a reação inversa como mineralização.
Sobre o sistema acima indicado, assinale a afirmação FALSA.
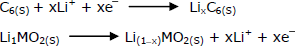
A respeito dessas semirreações pode-se afirmar corretamente que
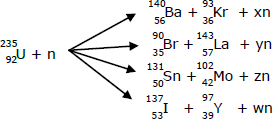
em que n é a representação da partícula atômica do nêutron e as letras x, y, z e w são coeficientes numéricos. Os valores de x, y, z e w, nesta ordem, são
Considere que um atleta com M kg de massa, partindo do repouso, comece a correr com aceleração constante de a m/s² ; que, enquanto corre, o atleta sofre a ação de uma força de resistência constante igual a R newtons; que toda a energia do atleta resulta da oxidação de gordura, a qual é representada pela expressão a seguir, em que E é a energia, em joules, liberada por mol de gordura.
C3H5O3(OC4H7)3 + 18,502 ? 15CO2 + 13H2O + E
Supondo-se que a eficiência do atleta seja 0, então a expressão matemática que representa a quantidade de moles N de gás carbônico produzido pelo atleta até o tempo t, em segundos, transcorrido desde o momento em que ele iniciou a corrida, é
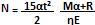
Considere que uma pessoa que pese 60 kg tenha subido, com velocidade constante, uma ladeira de 30° de inclinação, mantendo uma respiração que consome 0,78 L de O2 por minuto. Nesse caso, se toda a produção de energia interna vier da oxidação de glicose, então essa pessoa terá caminhado, em uma hora, menos de 3,5 km.
A reação de combustão da glicose, por ser endotérmica, é um processo espontâneo.
Considere que um painel com eficiência de 50% na conversão da radiação solar em calor esteja instalado em uma região onde a quantidade de energia irradiada pelo Sol é de 334,4 kJ por minuto. Nessa situação, assumindo-se que a água tem calor específico de 4,18 J/g °C e densidade de 1g/cm³ , o tempo necessário para se elevar a temperatura de 500 L de água de 25 ºC para 45 ºC é igual a
Considerando-se o rendimento de 100% para a reação de combustão do nitrato de amônio, é correto afirmar que a quantidade de explosivo utilizada na referida demolição da arquibancada do estádio Mané Garrincha produziu mais de 9,0 × 105 kJ de energia.



