Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões

De acordo com os estudos de Germain Henry Hess, professor da Universidade de São Petersburgo, no século XIX, a variação de entalpia em uma reação química depende apenas dos estados inicial e final de reagentes e de produtos da reação. A Lei de Hess contribuiu para o nascimento do princípio da conservação de energia.
A partir da aplicação da Lei de Hess, ao sistema de equações
termoquímicas I e II, é possível calcular a variação de entalpia
da reação representada pela equação química III.
Dessa forma, é correto afirmar:
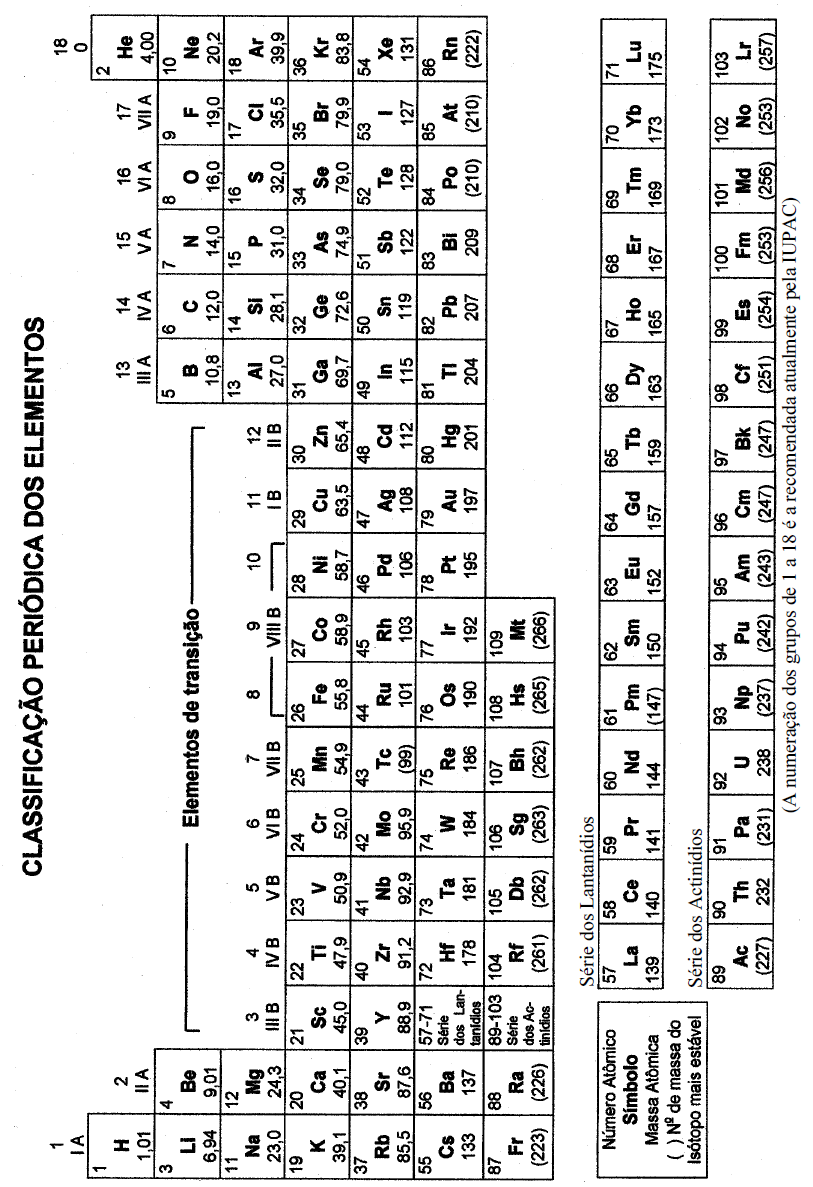
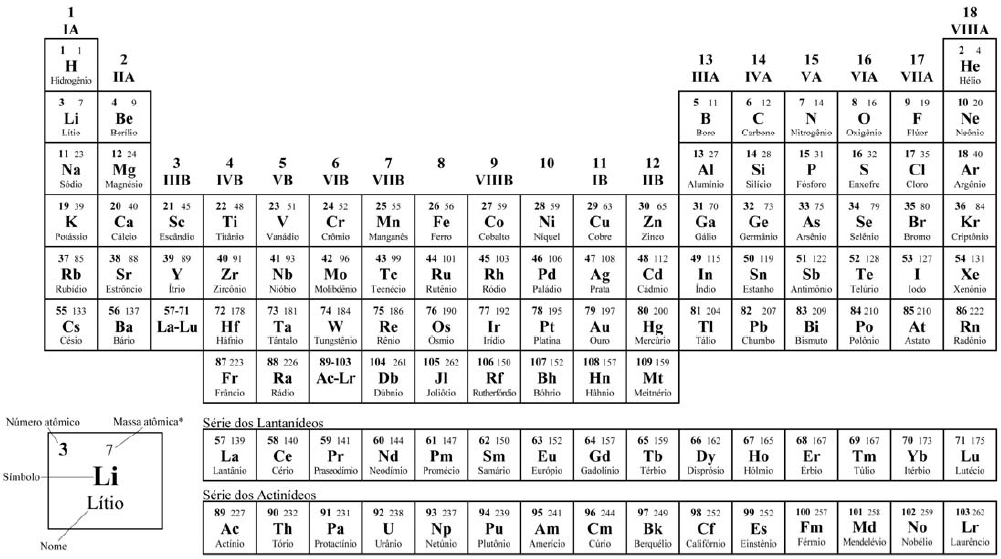
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
No tanque de um automóvel, há 30 litros de um combustível composto por gasolina (isoctano) e álcool etílico, numa proporção de 75% para 25%, respectivamente, em volume. Considerando que as reações de combustão ocorram com 100% de rendimento e os dados apresentados abaixo, assinale o que for correto.
1 C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

No tanque de um automóvel, há 30 litros de um combustível composto por gasolina (isoctano) e álcool etílico, numa proporção de 75% para 25%, respectivamente, em volume. Considerando que as reações de combustão ocorram com 100% de rendimento e os dados apresentados abaixo, assinale o que for correto.
1 C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)
A questão se refere ao texto a seguir.
Na agricultura, é muito comum a utilização de fertilizantes agrícolas, os quais contêm normalmente três ingredientes principais:
I. Nitrogênio (numa forma combinada, comumente nitrato de amônio ou outros sais de amônio ou ureia);
II. Fósforo (usualmente na forma de fosfatos solúveis);
III. Potássio (na forma de sais, como o sulfato de potássio).
Sobre essas informações, assinale o que for
correto.
A questão se refere ao texto a seguir.
Na agricultura, é muito comum a utilização de fertilizantes agrícolas, os quais contêm normalmente três ingredientes principais:
I. Nitrogênio (numa forma combinada, comumente nitrato de amônio ou outros sais de amônio ou ureia);
II. Fósforo (usualmente na forma de fosfatos solúveis);
III. Potássio (na forma de sais, como o sulfato de potássio).
Sobre essas informações, assinale o que for
correto.


representa a curva de aquecimento, sob pressão
de 1,0 atm, em cal × °C de 10,0 g de um material
hipotético. Sobre esse material, assinale o que for
correto.


representa a curva de aquecimento, sob pressão
de 1,0 atm, em cal × °C de 10,0 g de um material
hipotético. Sobre esse material, assinale o que for
correto.
I. C(graf) + O2(g) → CO2(g) ΔH°= – 394 kJ/mol
II. H2(g) + 1/2 O2(g) → H2O(ℓ) ΔH° = – 242 kJ/mol
III. C(graf) + 2 H2(g) → CH4(g) ΔH° = – 74 kJ/mol
IV. 2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H5OH(ℓ) ΔH° = – 278 kJ/mol
É correto afirmar que
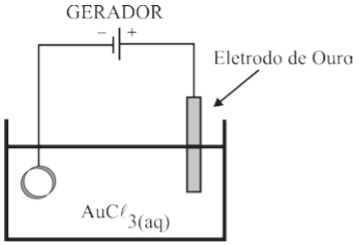
Dados: Au = 197 g/mol e 1 mol de elétrons = 9,6∙104 C.
A respeito do processo eletroquímico ilustrado acima, considere as afirmações dadas, de I a V.
I. O anel foi colocado no ânodo da cuba eletrolítica.
II. Ao passar uma corrente de 3 ampères, durante 16 minutos, há a deposição de aproximadamente 2,0 g de ouro sobre o anel.
III. No polo positivo ocorre a reação Au(s) → Au3+(aq) + 3 e-.
IV. No cátodo da cela eletrolítica ocorre oxidação.
V. No anel ocorre a reação Au3+(aq) + 3 e- → Au(s).
Dessas afirmações, estão corretas, somente
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
A película escura, Ag2S, tem duplo papel, funcionando como agente redutor e como oxidante,
pois forma Ag0
e S2-
.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
A semirreação, já balanceada, de deposição da prata na superfície da peça, pode ser
representada como: 3Ag2S(s) + 6e-
→ 6Ag(s) + 3S2-
.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
O papel alumínio é apenas um protetor da peça de prata porque o agente redutor, neste caso,
é o bicarbonato de sódio, que se oxida e forma o dióxido de carbono como um dos produtos.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
À medida que a reação ocorre, uma pequena quantidade de alumínio na folha é oxidada,
dissolvendo-se na solução.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
A folha de papel alumínio, menor potencial de redução, é o catodo e a peça de prata é o
anodo.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
A maneira caseira de remover películas escuras de pratarias representa um exemplo de célula
galvânica.
Um indicador de poluição difusa de água subterrânea é o nitrato. Sua origem está relacionada a atividades agrícolas e esgotos sanitários. Sendo o nitrato uma forma estável de nitrogênio em condições anaeróbias, esta substância pode ser considerada persistente e sua remoção da água, para atender ao padrão de potabilidade que é de 10 mg/L, é onerosa e, por vezes, tecnicamente inviável, prejudicando o abastecimento público e privado.
Disponível em: <http://www.cetesb.sp.gov.br/Solo/agua_sub/poluicao.asp> Acesso em: 03 set. 2010. (Adaptado)
Considere as seguintes reações utilizadas para a determinação de nitrato.
Sobre o assunto e as reações acima, assinale a proposição CORRETA.
Na primeira reação ocorre a conversão de nitrato para nitrito.
Um indicador de poluição difusa de água subterrânea é o nitrato. Sua origem está relacionada a atividades agrícolas e esgotos sanitários. Sendo o nitrato uma forma estável de nitrogênio em condições anaeróbias, esta substância pode ser considerada persistente e sua remoção da água, para atender ao padrão de potabilidade que é de 10 mg/L, é onerosa e, por vezes, tecnicamente inviável, prejudicando o abastecimento público e privado.
Disponível em: <http://www.cetesb.sp.gov.br/Solo/agua_sub/poluicao.asp> Acesso em: 03 set. 2010. (Adaptado)
Considere as seguintes reações utilizadas para a determinação de nitrato.
Sobre o assunto e as reações acima, assinale a proposição CORRETA.
A primeira reação é de oxirredução onde o nitrogênio é oxidado.