Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
Foram estudados, independentemente, o comportamento de uma amostra de 100 mg do radioisótopo bismuto-212 e o de uma amostra de 100 mg do radioisótopo bismuto-214. Essas espécies sofrem desintegração radioativa distinta,sendo o bismuto-212 um emissor β, enquanto que o bismuto-214 é um emissor α.
As variações das massas desses radioisótopos foram acompanhadas ao longo dos experimentos. O gráfico a seguir ilustra as observações experimentais obtidas durante as primeiras duas horas de acompanhamento.
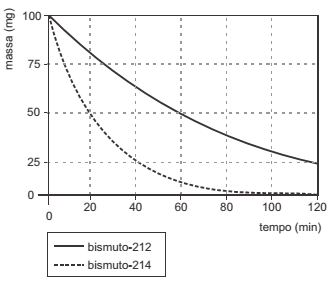
Sobre esse experimento é INCORRETO afirmar que
Dados:
Entalpia de formação padrão do O3 : 143 kJ.mol–1
Entalpia de ligação O=O: 498 kJ.mol-1
NO (g) + O3(g) → NO2(g) + O2(g) ΔHθ = – 200 kJ
Diversas reações ocorrem na atmosfera devido à ação da luz solar e à presença de poluentes. Uma das reações relevantes é a decomposição do dióxido de nitrogênio em óxido nítrico e oxigênio atômico.
NO2(g) → NO(g) + O(g)
A partir dos dados é possível concluir que essa reação é
Fotossíntese artificial gera hidrogênio para células a combustível
Redação do Site Inovação Tecnológica - 18/02/2010
Fontes de energia do futuro
Células a combustível alimentadas por hidrogênio e por energia solar são as duas maiores esperanças para as fontes de energia do futuro, por serem mais amigáveis ambientalmente e, sobretudo, sustentáveis.
A combinação das duas, então, é considerada como particularmente limpa: produzir hidrogênio para alimentar as células a combustível, quebrando moléculas de água com a luz solar, seria de fato o melhor dos mundos.
Esta é a chamada fotossíntese artificial, que vem sendo alvo de pesquisas de vários grupos de cientistas, ao redor do mundo.
Eletrodo fotocatalítico
Uma equipe liderada por Thomas Nann e Christopher Pickett, da Universidade de East Anglia, no Reino Unido, criou um fotoeletrodo eficiente, robusto, que pode ser fabricado com materiais comuns e de baixo custo.
O novo sistema consiste de um eletrodo de ouro que é recoberto com camadas formadas por nanopartículas de fosfeto de índio (InP). A esse eletrodo, os pesquisadores adicionaram um composto de ferro-enxofre [Fe2 S2 (CO)6 ] sobre as camadas.
Quando submerso em água e iluminado com a luz do Sol, sob uma corrente elétrica relativamente fraca, este sistema fotoeletrocatalítico produz hidrogênio com uma eficiência de 60%.
(
Considerando as substâncias químicas empregadas na construção do eletrodo fotocatalítico, o qual permite a realização da fotossíntese artificial, pode-se notar que há uma substância simples, formada por átomos de um único elemento químico, e substâncias compostas, formadas por átomos de mais de um elemento químico.
A única substância simples empregada nesse eletrodo é
Em relação à eletrólise,
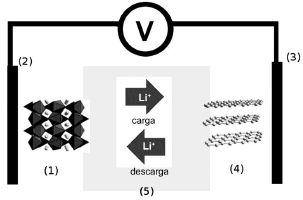
Quando a bateria está em uso (atuando como uma pilha), o anodo corresponde ao componente:

Em um experimento em laboratório de química, montou-se uma célula eletrolítica de acordo com o esquema:
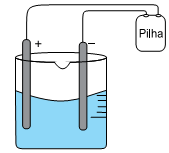
Usaram-se como eletrodo dois bastões de grafite, uma solução aquosa 1,0 mol.L–1 de CuSO4 em meio ácido a 20 °C e uma pilha.
Alguns minutos, após iniciado o experimento, observaram-se a formação de um sólido de coloração amarronzada sobre a superfície do eletrodo de polo negativo e a formação de bolhas na superfície do eletrodo de polo positivo.
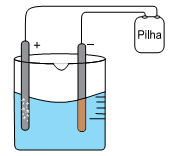
Com base nos potenciais de redução a 20 °C,
Cu2+ (aq) +2e– → Cu (s) + 0,34 V
2H+ (aq) + 2e– → H2 (g) 0,00 V
O2 (g) + 4H+ (aq) + 4e– → H2O (l) + 1,23 V
É correto afirmar que se forma cobre no
O ácido nítrico é um importante insumo para produção de fertilizantes, explosivos e tintas. Sua produção industrial é feita pelo processo Ostwald, em três etapas que podem ser representadas pelas reações:
I. 6 NH3 (g) + 15/2 O2 (g) → 6 NO (g) + 9 H2O (g) ∆H = – 1378 kJ
II. 6 NO (g) + 3 O2 (g) → 6 NO2 (g) ∆H = – 339 kJ
III. 6 NO2
(g) + 2 H2O (g) → 4 HNO3
(aq) + 2 NO (g) ∆H = – 270 kJ
A medicina tem desenvolvido diversos tratamentos para pacientes com câncer de cérebro. Em um deles, o paciente ingere o composto borofenilalanina. Essa molécula que contém o isótopo boro-10 tem afinidade pelas células cerebrais. Após a ingestão, o paciente é submetido a um feixe de nêutrons. Cada isótopo de boro-10 captura um nêutron e forma um isótopo instável que se fissiona em duas espécies menores e emite ainda radiação gama. Dessa maneira, a célula tumoral é atingida pela energia das emissões do processo de fissão e é destruída.
(www.nipe.unicamp.br/enumas/admin/resources/uploads/robertovicente_hasoluçao.pdf.Adaptado)
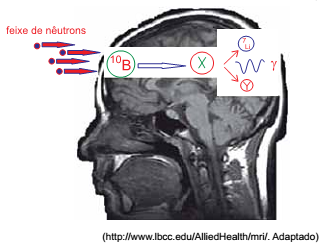
O isótopo instável, representado por X, e a espécie emitida
na fissão, representada por Y, são, respectivamente,
Pouco depois de a bomba atômica ser lançada sobre o Japão, cientistas inventaram outra arma, ainda mais poderosa: a bomba de hidrogênio. Em 1957, a bomba H explodia no atol de Bikini, no Oceano Pacífico.Tinha um poder de destruição cinco vezes maior do que todas as bombas convencionais detonadas durante a Segunda Guerra Mundial.
Prevendo a corrida armamentista, Albert Einstein declarou em 1945: “O poder incontrolado do átomo mudou tudo, exceto nossa forma de pensar e, por isso, caminhamos para uma catástrofe sem paralelo".

Disponível em:<http://www.sitedecuriosidades.com/curiosidade/as-bombas-atomicas-lancadas-sobre-o-japao.html><http://www.nippo.com.br/4.hiroshima/>.<http://pt.wikipedia.org/wiki/Bombardeamentos de Hiroshima e Nagasaki>. Acesso em: 2 set. 15.
Em relação à temática e às informações apresentadas no texto, assinale a alternativa correta.
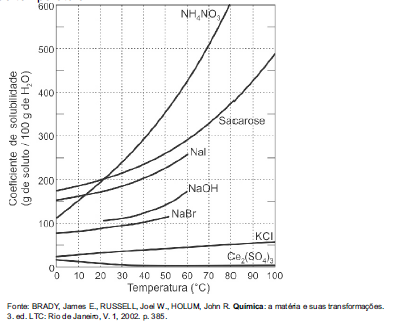
Considerando as informações apresentadas pelo gráfico acima, assinale a alternativa correta.
A equação química que descreve, simplificadamente, o processo de obtenção industrial do 1,2-dicloroetano, a partir da reação de adição de gás cloro ao eteno, encontra-se representada abaixo.
C2H4(g) + Cℓ2(g) ® C2H4Cℓ2(ℓ)
Disponível em:<http://laboratorios.cetesb.sp.gov.br/wp-content/uploads/sites/47/2013/11/dicloroetano.pdf>. Acesso em: 3 set. 15. (Adaptado.)
A variação de entalpia da reação acima é igual a
Dados:
Ligação Energia de ligação (kJ/mol)
C–H 413,4
C–Cℓ 327,2
C–C 346,8
C=C 614,2
Cℓ–Cℓ 242,6
TEXTO 7
Memórias de um pesquisador
Não era bem vida, era uma modorra – mas de qualquer modo suportável e até agradável. Terminou bruscamente, porém, eu estando com vinte e oito anos e um pequeno bujão de gás explodindo mesmo à minha frente, no laboratório de eletrônica em que trabalhava, como auxiliar. Me levaram às pressas para o hospital, os médicos duvidando que eu escapasse. Escapei, mas não sem danos. Perdi todos os dedos da mão esquerda e três (sobraram o polegar e o mínimo) da direita. Além disso fiquei com o rosto seriamente queimado. Eu já não era bonito antes, mas o resultado final – mesmo depois das operações plásticas – não era agradável de se olhar. Deus, não era nada agradável.
No entanto, nos primeiros meses após o acidente eu não via motivos para estar triste. Aposentei-me com um bom salário. Minha velha tia, com quem eu morava, desvelava-se em cuidados. Preparava os pastéis de que eu mais gostava, cortava-os em pedacinhos que introduzia em minha boca – derramando sentidas lágrimas cuja razão, francamente, eu não percebia. Deves chorar por meu pai – eu dizia – que está morto, por minha mãe que está morta, por meu irmão mais velho que está morto; mas choras por mim. Por quê? Escapei com vida de uma explosão que teria liquidado qualquer um; não preciso mais trabalhar; cuidas de mim com desvelo; de que devo me queixar?
Cedo descobri. Ao visitar certa modista.
Esta senhora, uma viúva recatada mas ardente, me recebia todos os sábados, dia em que os filhos estavam fora. Quando me senti suficientemente forte telefonei explicando minha prolongada ausência e marcamos um encontro.
Ao me ver ficou, como era de se esperar, consternada. Vais te acostumar, eu disse, e propus irmos para a cama. Me amava, e concordou. Logo me deparei com uma dificuldade: o coto (assim eu chamava o que tinha me sobrado da mão esquerda) e a pinça (os dois dedos restantes da direita) não me forneciam o necessário apoio. O coto, particularmente, tinha uma certa tendência a resvalar pelo corpo coberto de suor da pobre mulher. Seus olhos se arregalavam; quanto mais apavorada ficava, mais suava e mais o coto escorregava.
Sou engenhoso. Trabalhando com técnicos e cientistas aprendi muita coisa, de modo que logo resolvi o problema: com uma tesoura, fiz duas incisões no colchão. Ali ancorei coto e pinça. Pude assim amá-la, e bem.
– Não aguentava mais – confessei, depois. – Seis meses no seco!
Não me respondeu. Chorava. – Vais me perdoar, Armando – disse – eu gosto de ti, eu te amo, mas não suporto te ver assim. Peço-te, amor, que não me procures mais.
– E quem vai me atender daqui por diante? – perguntei, ultrajado.
Mas ela já estava chorando de novo. Levantei-me e saí. Não foi nessa ocasião, contudo, que fiquei deprimido. Foi mais tarde; exatamente uma semana depois.
[...]
(SCLIAR, Moacyr. Melhores contos. Seleção de
Regina Zilbermann. São Paulo: Global, 2003. p.
176-177.)
A pólvora, usada como explosivo desde tempos remotos, é uma mistura de nitrato de potássio, enxofre e carvão. Com a explosão, ocorre formação de sulfato de potássio, dióxido de carbono e nitrogênio molecular.
Sobre essa explicação acerca da explosão, assinale a única afirmação correta:
TEXTO 1
O mundo do menino impossível
Fim de tarde, boquinha da noite
com as primeiras estrelas e os derradeiros sinos.
Entre as estrelas e lá detrás da igreja,
surge a lua cheia
para chorar com os poetas.
E vão dormir as duas coisas novas desse mundo:
o sol e os meninos.
Mas ainda vela
o menino impossível,
aí do lado,
enquanto todas as crianças mansas
dormem
acalentadas
por Mãe-negra da Noite.
O menino impossível
que destruiu
os brinquedos perfeitos
que os vovós lhe deram:
o urso de Nurnberg,
o velho barbado jugoslavo,
as poupées de Paris aux
cheveux crêpés,
o carrinho português
feito de folha de flandres a
caixa de música checoslovaca,
o polichinelo italiano
made in England,
o trem de ferro de U. S. A.
e o macaco brasileiro
de Buenos Aires,
moviendo la cola y la cabeza.
O menino impossível
que destruiu até
os soldados de chumbo de Moscou
e furou os olhos de um Papá Noel,
brinca com sabugos de milho,
caixas vazias,
tacos de pau,
pedrinhas brancas do rio...
“Faz de conta que os sabugos
são bois...”
“Faz de conta...”
“Faz de conta...”
[...]
O menino pousa a testa
e sonha dentro da noite quieta
da lâmpada apagada,
com o mundo maravilhoso
que ele tirou do nada...
[...]
(LIMA, Jorge de. Melhores poemas. São Paulo: Global,
2006. p. 27-30. Adaptado.)
Ao morrer, esses seres param de “reciclar" o carbono e a quantidade de carbono 14 em relação ao 12 começa a decair. Quando essa relação for de 50% da original, chama-se meia-vida do carbono 14. No caso do chumbo, esse tempo de meia-vida é de 22 anos. A quantidade de carbono 14 existente em um determinado instante t é dada pela função exponencial Q(t)=Q(0) exp(-kt), em que Q(0) é a quantidade de carbono 14 no instante 0, e k é a constante, que depende do tipo de elemento radioativo. No caso do chumbo, o valor de k é (marque a alternativa correta):


Considere as seguintes afirmações:
I. A aparência macroscópica do fleróvio é desconhecida, mas, provavelmente, será a de um sólido metálico.
II. Na formação do fleróvio-288, por processo análogo ao da síntese do fleróvio-289, são liberados 3 prótons.
III. No grupo da tabela periódica ao qual pertence o fleróvio, há elementos que formam óxidos covalentes.
É correto o que se afirma apenas em
Note e adote: Volume molar nas condições de produção de biogás: 24 L/mol; energia liberada na combustão completa da gasolina: 4,5 x 104 kJ/L.