Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões


A obtenção do silício para uso na fabricação de processadores envolve uma série de etapas. Na primeira, obtém-se o silício metalúrgico, por reação do óxido com coque, em forno de arco elétrico, à temperatura superior a 1 900 ºC. Uma das equações que descreve o processo de obtenção do silício é apresentada a seguir:
SiO2 (s) + 2C(s) → Si(L) + 2CO(g)
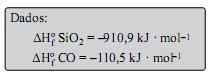
De acordo com as informações do texto, é correto afirmar que o processo descrito para a obtenção do silício metalúrgico corresponde a uma reação
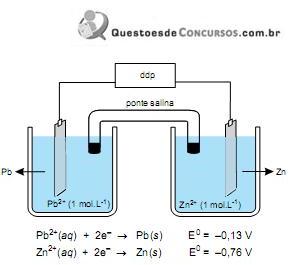
A partir da análise da figura, é correto afirmar que essa pilha tem ddp igual a
É possível construir uma pilha eletroquímica colocando em um copo de vidro papel alumínio amassado, palha de aço e papel amassado para separar os dois metais. É necessário que os metais e o papel estejam submersos em uma solução de cloreto de sódio (sal de cozinha). Ligando-se um fo no alumínio e outro na palha de aço e conectando-os aos polos de um relógio digital comum de parede, é possível fazê-lo funcionar por algum tempo.
As equações parciais propostas para essa reação são:
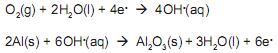
As informações apresentadas permitem concluir que

Sobre essa tentativa de síntese da quinina de Perkin, é correto afirmar que

A análise das informações permite concluir que
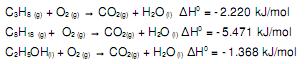
Com base nas fórmulas dos combustíveis e nas equações, considere as afirmativas a seguir:
I) O propano e o noctano são hidrocarbonetos saturados.
II) O noctano é aquele que libera maior quantidade de CO2(g) por mol de combustível
III) A soma dos coeficientes estequiométricos da reação de combustão do etanol é 8.
IV) 50 g de noctano libera maior quantidade de energia do que 100 g de propano.
Estão corretas apenas as afirmativas:
Analise os processos a seguir:
I. oxidação de nitrogênio: N2(g) + 2O2(g) →2NO2(g)
II. fotossíntese da glicose: 6CO2(g) + 6H2O(g) → C6H12O6(s) + 6O2(g)
III. evaporação da água de roupas úmidas
IV. dissolução do sal: KNO3(s) → K+ (aq) + NO3 - (aq)
Ocorre aumento de entropia durante os processos
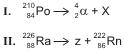
O ano de 2011 foi escolhido pela UNESCO e pela União Internacional de Química Pura e Aplicada, IUPAC, como o Ano Internacional da Química, em homenagem ao centenário do prêmio Nobel de 1911, recebido por Marie Curie, uma das responsáveis pela descoberta dos radionuclídeos polônio e rádio, cujas reações de desintegração nucleares estão representadas, respectivamente, pelas equações I e II.
Considerando-se as informações do texto e as equações que representam a desintegração dos radionuclídeos polônio e rádio, é correto afirmar:
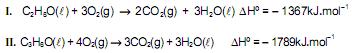
Os processos de combustão do etanol,
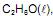 utilizado como combustível em veículos, e da propanona,
utilizado como combustível em veículos, e da propanona, 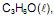 solvente de tintas e vernizes, são representados, respectivamente, pelas equações termoquímicas I e II.
solvente de tintas e vernizes, são representados, respectivamente, pelas equações termoquímicas I e II. Considerando-se essas informações e a densidade do etanol igual a 0,8g.mL, é correto concluir:
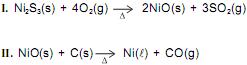
Um dos processos de obtenção do níquel, metal utilizado na fabricação de moedas, consiste, inicialmente, no aquecimento de sulfeto de níquel(III) na presença de ar. Durante esse processo, são formados óxido de níquel(II) e de dióxido de enxofre, de acordo com a equação química I, e, posteriormente, o NiO(s) reage com o carvão, em forno siderúrgico, com obtenção do níquel metálico e do monóxido de carbono, conforme reação representada na equação química II.
Considerando-se as informações do texto e as equações químicas I e II que representam, resumidamente, esse processo, é correto afirmar:
saponificação dos óleos vegetais são utilizados como sabões.
Entretanto, em regiões cujas águas são ricas em metais
alcalinoterrosos (chamadas águas duras), principalmente Ca2+ eMg 2+
, os sabões perdem eficiência devido à baixa solubilidade dos
sais orgânicos desses metais, o que causa a precipitação.
Com base nessas informações e considerando as soluções ideais,
julgue os itens 148 e 149 e assinale a opção correta no item 150, que
é do tipo C.
