Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
Dadas as assertivas abaixo,
I. Quando um núcleo emite uma partícula beta (ß), o seu número atômico diminui de uma unidade.
II. Na fusão nuclear, um núcleo atômico é formado a partir de dois núcleos menores com liberação de energia.
III. Quando um núcleo atômico emite uma partícula alfa
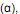 o seu número de massa aumenta de quatro unidades.
o seu número de massa aumenta de quatro unidades. IV. Um elemento químico tem uma meia-vida de 10 horas. Se partirmos de 80g deste elemento, após 40 horas a massa desintegrada é de 5g.
verifica-se que está(ão) correta(s)
Dadas as entalpias das seguintes reações,
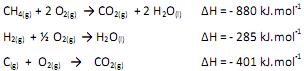
a formação do metano gasoso a partir do carbono grafite e hidrogênio gasoso é uma reação
I. As reações envolvidas nesse processo são de óxido-redução.
II. O escurecimento do objeto de prata se deve a prata na sua forma oxidada.
III. A prata volta a brilhar porque sofre uma reação de oxidação e volta para a sua forma metálica (Ag).
IV. A prata volta a brilhar porque sofre uma reação de redução e volta para a sua forma metálica (Ag).
V. O alumínio é extremamente necessário, pois participa da reação que envolve transferência de elétrons.
verifica-se que estão corretos apenas
KMnO4 (aq) +HF (aq) → KF (aq) + MnF2 (aq) + H2O (l) + F2 (g)
Balanceie a equação química e, baseando-se na equação balanceada, assinale a proposição correta acerca dos estados de oxidação das espécies químicas e da estequiometria da reação:
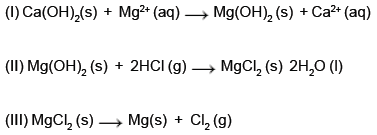
A partir das reações representadas e das propriedades dos elementos e substâncias, é correto afirmar:
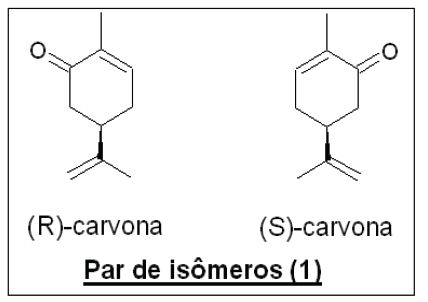
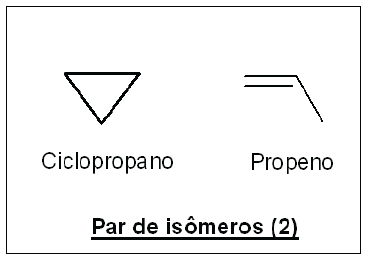
Acerca das propriedades e da relação de isomeria entre os compostos, é correto afirmar:
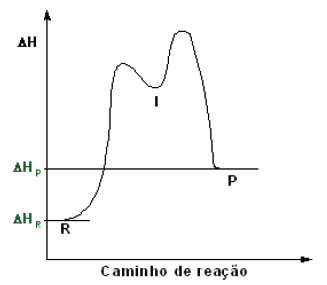
Admitindo que R corresponde aos reagentes, I ao intermediário e P aos produtos, é correto afirmar que
 Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V 

A equação química a seguir representa a obtenção de glicose a partir do glicogênio.
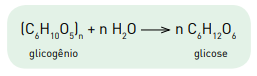
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona
o ganho de energia, em quilojoules, equivalente a:
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
Com relação ao ferro, assinale a opção correta.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
Ag(s) + H2S(g) + O2(g) → Ag2S(s) + H2O(l)
Considerando esse processo, assinale a opção correta.