Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 967 questões
A decomposição de uma amostra de carbonato de cálcio consumiu 266 kJ. A partir desse resultado e da equação termoquímica abaixo, conclui-se que:
CaCO3(s) → CaO(s) + CO2(g); ΔH = +133 kJ mol-1
A reação do iodato de potássio com bissulfito de sódio, em meio aquoso pode ser representada na sua forma iônica, sem os íons espectadores, como segue:
IO3-(aq) + HSO3-(aq) → I-(aq) + SO42-(aq) + H+(aq)
No balanço de massa e no balanço de carga com os menores coeficientes inteiros, a relação entre as quantidades, em mol, da espécie oxidante e da espécie redutora é de:



Quanto à radioatividade, infere-se que
O lança-perfume é uma droga inalante consumida principalmente no Carnaval. É constituído por solventes voláteis que, quando inalados, são levados, via corrente sanguínea, para todo o organismo. Por induzir a produção de adrenalina no organismo, a droga acelera a frequência cardíaca, proporcionando sensação de euforia e desinibição, ao mesmo tempo em que confere
perturbações auditivas e visuais, perda de autocontrole e visão confusa. O cloreto de etila
 e o éter dietílico
e o éter dietílico  , componentes principais do lança-perfume, podem ser sintetizados a partir do
, componentes principais do lança-perfume, podem ser sintetizados a partir do  , de acordo com as
, de acordo com asreações a seguir.

Considerando as reações acima e os valores de entalpias padrão de
formação —
 — a 25 ºC, apresentados na tabela, julgue os itens seguintes.
— a 25 ºC, apresentados na tabela, julgue os itens seguintes. Os fogos de artifício são dispositivos envolvidos em um cartucho de papel. Na parte inferior, está a carga explosiva, que dispara os fogos para o alto. O propelente mais utilizado é a pólvora negra, uma mistura de nitrato de potássio, enxofre e carvão. Para a produção de fogos coloridos, misturam-se sais de diferentes metais à pólvora. Elétrons dos metais, quando são excitados pelo calor, emitem, ao retornarem a níveis de energia mais baixos, radiação eletromagnética de diferentes cores. Na tabela abaixo, são listados alguns metais e a coloração característica que deles pode ser emitida.

A seguir, é apresentada uma reação da pólvora, sem balanceamento e sem os estados físicos das substâncias.

Tendo como referência as informações acima, julgue os itens seguintes.
O titânio encontrado na natureza apresenta cinco isótopos estáveis.
Em condições especiais, outros radioisótopos podem ser formados, sendo muito curto o tempo de meia-vida da maior parte deles.
Considerando que o radioisótopo 54Ti tenha tempo de meia-vida
igual a 1,5 s e sofra desintegração emitindo radiação ß, julgue os
itens a seguir.
O titânio encontrado na natureza apresenta cinco isótopos estáveis.
Em condições especiais, outros radioisótopos podem ser formados, sendo muito curto o tempo de meia-vida da maior parte deles.
Considerando que o radioisótopo 54Ti tenha tempo de meia-vida
igual a 1,5 s e sofra desintegração emitindo radiação ß, julgue os
itens a seguir.

A infraestrutura precária de alguns locais que sediam
eventos com grande público, como jogos de futebol e shows
musicais, e a falta de educação de pessoas que insistem em urinar
em locais completamente inapropriados, como paredes e viadutos,
têm causado sérios problemas. Além do mau cheiro, o ácido úrico,
presente na urina, penetra pelos poros do concreto e causa corrosão
de estruturas metálicas.
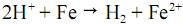 , a reação de oxidação do ferro em meio ácido, tem, a 25 º C, potencial elétrico padrão, igual a 0,44 V.
, a reação de oxidação do ferro em meio ácido, tem, a 25 º C, potencial elétrico padrão, igual a 0,44 V. Dadas as assertivas abaixo,
I. Quando um núcleo emite uma partícula beta (ß), o seu número atômico diminui de uma unidade.
II. Na fusão nuclear, um núcleo atômico é formado a partir de dois núcleos menores com liberação de energia.
III. Quando um núcleo atômico emite uma partícula alfa
 o seu número de massa aumenta de quatro unidades.
o seu número de massa aumenta de quatro unidades. IV. Um elemento químico tem uma meia-vida de 10 horas. Se partirmos de 80g deste elemento, após 40 horas a massa desintegrada é de 5g.
verifica-se que está(ão) correta(s)
Dadas as entalpias das seguintes reações,
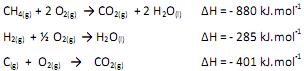
a formação do metano gasoso a partir do carbono grafite e hidrogênio gasoso é uma reação
I. As reações envolvidas nesse processo são de óxido-redução.
II. O escurecimento do objeto de prata se deve a prata na sua forma oxidada.
III. A prata volta a brilhar porque sofre uma reação de oxidação e volta para a sua forma metálica (Ag).
IV. A prata volta a brilhar porque sofre uma reação de redução e volta para a sua forma metálica (Ag).
V. O alumínio é extremamente necessário, pois participa da reação que envolve transferência de elétrons.
verifica-se que estão corretos apenas
KMnO4 (aq) +HF (aq) → KF (aq) + MnF2 (aq) + H2O (l) + F2 (g)
Balanceie a equação química e, baseando-se na equação balanceada, assinale a proposição correta acerca dos estados de oxidação das espécies químicas e da estequiometria da reação:
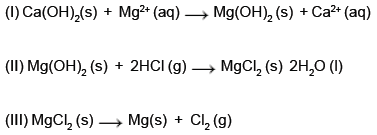
A partir das reações representadas e das propriedades dos elementos e substâncias, é correto afirmar:
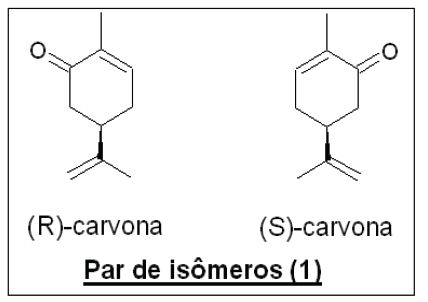
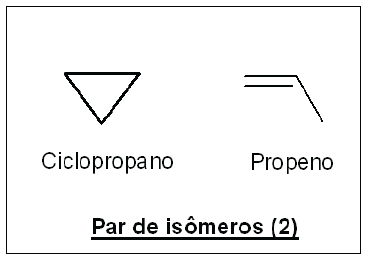
Acerca das propriedades e da relação de isomeria entre os compostos, é correto afirmar:
