Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
Substância Entalpia de formação
Amônia(g) - 10,9 kcal/mol Cloreto de hidrogênio(g) - 21.9 kcal/mol Cloreto de amônio(s) - 74.9 kcal/mol

O princípio de funcionamento dessa espécie de ar-condicionado baseia-se no fato de o gelo sofrer uma
Substâncias que contêm um metal de transição podem ser oxidantes. Quanto maior o número de oxidação desse metal, maior o caráter oxidante da substância.
Em um processo industrial no qual é necessário o uso de um agente oxidante, estão disponíveis apenas quatro substâncias: FeO, Cu2 O, Cr2 O3 e KMnO4 .
A substância que deve ser utilizada nesse processo, por apresentar maior caráter oxidante, é:
(Considere 1 mol de elétrons – 96500 C)
Em relação à eletrólise, afirma-se:
I. É uma reação espontânea de oxidorredução produzida a partir da corrente elétrica.
II. Através da eletrólise ígnea do óxido de alumínio é possível obter, além de alumínio metálico, o oxigênio gasoso.
III. A redução ocorre no polo positivo denominado cátodo.
IV. A oxidação ocorre no polo positivo denominado ânodo.
V. Se numa célula eletrolítica industrial utilizarmos uma corrente elétrica de 19300 A, e admitindo uma eficiência de 90%, será possível produzir em um dia aproximadamente 140 Kg de alumínio.
Estão corretas APENAS:
K2Cr2O7(aq.) + H2SO4(aq.) + C2H5OH(v) → C2H4O(g) + K2SO4(aq.) + Cr2(SO4)3(aq.) + H2O(l)
Analise as afirmativas referentes a esse processo químico.
I. A equação química corretamente balanceada tem como soma dos menores números inteiros 31.
II. A equação química corretamente balanceada tem como soma dos menores coeficientes inteiros 20.
III. O etanol é oxidado a aldeído acético e o dicromato
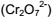 , amarelo-alaranjado, da
origem ao sulfato de íon crômio (III), verde.
, amarelo-alaranjado, da
origem ao sulfato de íon crômio (III), verde.
IV. O agente oxidante é o dicromato de potássio; portanto, ele contém o elemento que recebe elétrons, sofrendo redução.
V. O agente redutor é o ácido sulfúrico; portanto, contém o elemento que perde elétrons, sofrendo oxidação.
É correto o que se afirma APENAS em:
Dados: Massas molares (g/mol) H = 1,00 O = 16,0 Cu = 63,5
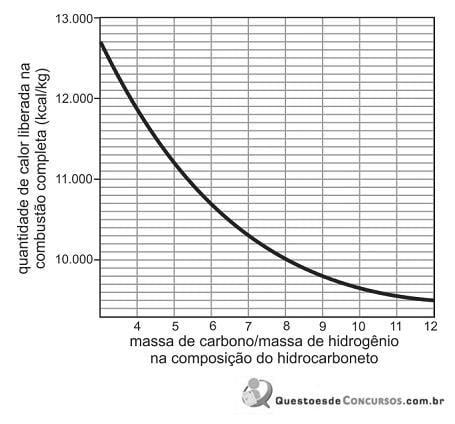
Com base no gráfico, um hidrocarboneto que libera 10.700 kcal/kg em sua combustão completa pode ser representado pela fórmula
Dados: Massas molares (g/mol) C = 12,0 H = 1,00
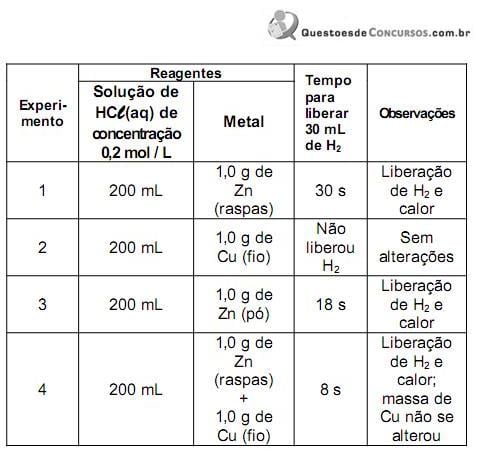
Após realizar esses experimentos, a estudante fez três afirmações:
I. A velocidade da reação de Zn com ácido aumenta na presença de Cu.
II. O aumento na concentração inicial do ácido causa o aumento da velocidade de liberação do gás H2.
III. Os resultados dos experimentos 1 e 3 mostram que, quanto maior o quociente superfície de contato/massa total de amostra de Zn, maior a velocidade de reação.
Com os dados contidos na tabela, a estudante somente poderia concluir o que se afirma em

A análise do gráfico permite concluir, corretamente, que:
Considerando essas amostras, as relações entre os calores específicos cX e cY , as capacidades térmicas CX e CY e as massas mX e mY são descritas por:

A energia, em quilocalorias, absorvida na dissolução de M corresponde a:
4 NH3(g) + 5 O2(g) 4 NO(g) + 6 H2O(g) ΔH = -900KJ
Sobre a reação, é correto afirmar que:
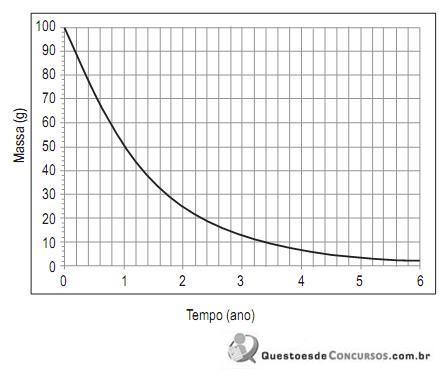
Partindo de 180 g de uma amostra desse isótopo radio- ativo, o que restará dela, em gramas, após dois anos é aproximadamente igual a:

Tendo como referência as informações acima, julgue os itens de 121 a 124 e faça o que se pede no item 125, que é do tipo B.
Sabendo que o césio-137
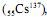 usado em aparelhos de radioterapia, tem meia-vida de 30 anos, calcule a quantidade de césio-137, em mols, que restarão, após 60 anos, em uma amostra que, inicialmente, continha 150 g desse isótopo. Multiplique o resultado encontrado por 100. Para a marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado final obtido, após ter efetuado todos os cálculos necessários.
usado em aparelhos de radioterapia, tem meia-vida de 30 anos, calcule a quantidade de césio-137, em mols, que restarão, após 60 anos, em uma amostra que, inicialmente, continha 150 g desse isótopo. Multiplique o resultado encontrado por 100. Para a marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado final obtido, após ter efetuado todos os cálculos necessários.
Tendo como referência as informações acima, julgue os itens de 121 a 124 e faça o que se pede no item 125, que é do tipo B.


Tendo como referência as informações acima, julgue os itens de 121 a 124 e faça o que se pede no item 125, que é do tipo B.

Com relação a esse assunto, julgue os itens de 98 a 101 e assinale a opção correta no item 102, que é do tipo C.
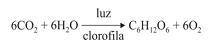
Sabendo-se que as entalpias padrão de formação do CO2, da água e da glicose são, respectivamente, iguais a - 427 kJ/mol, -280 kJ/mol e -1.036 kJ/mol, infere-se que essa reação é

Considerando as informações acima, julgue os itens 50 e 51, assinale a opção correta no item 52, que é do tipo C, e faça o que se pede no item 53, que é do tipo D.