Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
Depois de terem percorrido cerca de 80 km, os dois amigos param para abastecer o carro. Após o abastecimento, Carlos tenta dar partida no veículo, porém nada acontece. Como o carro tem mais de 20 anos, ele não se surpreende e desce do mesmo para dar uma olhada. Ao abrir o capô, percebe que há um acúmulo de material azul esverdeado (zinabre) envolvendo os eletrodos da bateria.
Dado: o zinabre é uma mistura de CuCO3 e Cu(OH)2.
Sobre o assunto, é CORRETO afirmar que:
para remover o zinabre do eletrodo seria adequado utilizar uma solução básica.
Depois de terem percorrido cerca de 80 km, os dois amigos param para abastecer o carro. Após o abastecimento, Carlos tenta dar partida no veículo, porém nada acontece. Como o carro tem mais de 20 anos, ele não se surpreende e desce do mesmo para dar uma olhada. Ao abrir o capô, percebe que há um acúmulo de material azul esverdeado (zinabre) envolvendo os eletrodos da bateria.
Dado: o zinabre é uma mistura de CuCO3 e Cu(OH)2.
Sobre o assunto, é CORRETO afirmar que:
a reação entre o dióxido de carbono e o óxido de cobre (II) envolve um processo de
oxirredução.
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes informações:
Expressão de equilíbrio:
H2C 
Dados termodinâmicos (a 298 K):
Keq=7,5 x 107
∆H0 = -84,1 kJ mol-1
Ea= 140 kJ mol-1

O fato da reação apresentar ∆H<0 indica que a velocidade de obtenção do CH3CH2Br é alta.
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes informações:
Expressão de equilíbrio:
H2C 
Dados termodinâmicos (a 298 K):
Keq=7,5 x 107
∆H0 = -84,1 kJ mol-1
Ea= 140 kJ mol-1

Com relação às informações acima, assinale a proposição CORRETA.
O valor de ∆H sugere que a reação é endotérmica.
Em abril de 1898, Marie Sklodowska Curie (1867-1934) e Pierre Curie (1859-1906), ao processar a pechblenda obtiveram duas frações radioativas. Uma delas apresentou uma radioatividade 400 vezes maior que a do urânio. O casal Curie associou essa radioatividade a um novo elemento químico, o qual foi denominado polônio, em homenagem à Polônia, terra natal de Marie Curie. O polônio foi o terceiro elemento radioativo identificado, depois do urânio e do tório, o que levou Marie Curie a receber o Prêmio Nobel de Química em 1911.
Na natureza há sete isótopos naturais do polônio, representados por: 210Po, 211Po, 212Po, 214Po, 215Po, 216Po e 218Po. Todos os isótopos desse elemento desintegram-se por emissão de partículas alfa, produzindo isótopos de chumbo. A elevada energia das partículas alfa emitidas pelo polônio permite a identificação de diminutas quantidades desse elemento em uma amostra. O polônio se dissolve em ácidos diluídos produzindo soluções contendo íons Po2+ .
Considere as informações acima e assinale a proposição CORRETA.
Emissões alfa são partículas negativas de massa muito pequena.
Em abril de 1898, Marie Sklodowska Curie (1867-1934) e Pierre Curie (1859-1906), ao processar a pechblenda obtiveram duas frações radioativas. Uma delas apresentou uma radioatividade 400 vezes maior que a do urânio. O casal Curie associou essa radioatividade a um novo elemento químico, o qual foi denominado polônio, em homenagem à Polônia, terra natal de Marie Curie. O polônio foi o terceiro elemento radioativo identificado, depois do urânio e do tório, o que levou Marie Curie a receber o Prêmio Nobel de Química em 1911.
Na natureza há sete isótopos naturais do polônio, representados por: 210Po, 211Po, 212Po, 214Po, 215Po, 216Po e 218Po. Todos os isótopos desse elemento desintegram-se por emissão de partículas alfa, produzindo isótopos de chumbo. A elevada energia das partículas alfa emitidas pelo polônio permite a identificação de diminutas quantidades desse elemento em uma amostra. O polônio se dissolve em ácidos diluídos produzindo soluções contendo íons Po2+ .
Considere as informações acima e assinale a proposição CORRETA.
Sabendo que a meia-vida do isótopo 210Po é de aproximadamente 140 dias, após 40
semanas o percentual desse isótopo na natureza será igual a 12,5%.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Na recarga, a liga metálica absorve hidrogênio.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Nas baterias de hidreto metálico, o hidrogênio é o polo positivo.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Na semirreação catódica, ocorre diminuição do número de oxidação do níquel.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Após a utilização, baterias de níquel-cádmio devem retornar aos revendedores para
destinação ambientalmente adequada.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Baterias secundárias são geradores de energia elétrica, do tipo não recarregável.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Durante o funcionamento das baterias de hidreto metálico, o número de oxidação do
hidrogênio permanece constante, igual a +1.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Nas baterias de hidreto metálico, o material ativo é o agente oxidante.

Observação: Algumas das questões desta prova são adaptações de situações reais. Alguns
dados e condições foram modificados para facilitar o trabalho dos candidatos.
Pedrinho, ao chegar da escola, explica para sua avó o que aprendeu sobre o funcionamento de uma panela de pressão. Ela ficou surpresa em saber como um utensílio doméstico comum serve para exemplificar e explicar muitos princípios físicos.
Independentemente de marca e modelo, além de cabos e tampa, toda panela de pressão é constituída basicamente de uma válvula com pino, que serve para controlar a pressão dentro da panela, e de uma válvula de segurança que se rompe, caso a válvula com pino não seja acionada.
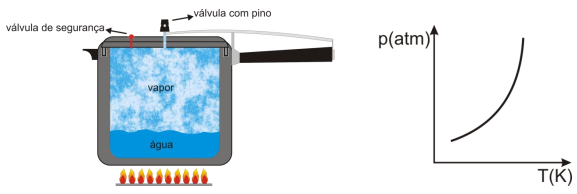
Com base no funcionamento da panela, nos princípios e fenômenos físicos envolvidos e no diagrama de fase acima, assinale a proposição CORRETA.
Na panela de pressão em contato com a chama, ocorre uma transformação isobárica
quando a válvula com pino é acionada.
Utilize as informações a seguir para responder à questão.
Cada mol de glicose metabolizado no organismo humano gera o equivalente a 3 000 kJ de
energia. A atividade da célula nervosa, em condições normais, depende do fornecimento
constante dessa fonte energética.
A equação química a seguir representa a obtenção de glicose a partir do glicogênio.
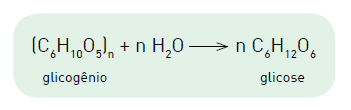
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 . A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a:
(C6H10O) n + nH2O → n C6H12O6 glicogênio glicose
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a:
Equação 1
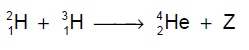
Equação 2

Em relação às equações, assinale a alternativa incorreta:
(I) H2O(l) → H2(g) + 1/2O2(g) ∆H = +286 kJ (II) H2(g) + ½ O2(g) → H2O(g) ∆H = - 242 kJ (III) H2O(l) → H2O(s) ∆H = - 7,3 kJ
De acordo com as equações acima e os seus conhecimentos de química, é incorreta a afirmativa:
O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Sobre as substâncias e as reações representadas por estas equações é incorreto afirmar que:
 O gás hilariante, N2O, age no sistema nervoso central e provoca
risos descontrolados. É um anestésico que pode causar
degeneração da coluna vertebral e perda temporária do controle
motor. Um dos métodos de obtenção desse gás é o de
decomposição térmica do nitrato de amônio, NH4NO3(s), de
acordo com a equação química
O gás hilariante, N2O, age no sistema nervoso central e provoca
risos descontrolados. É um anestésico que pode causar
degeneração da coluna vertebral e perda temporária do controle
motor. Um dos métodos de obtenção desse gás é o de
decomposição térmica do nitrato de amônio, NH4NO3(s), de
acordo com a equação química 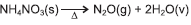 . A partir dessas informações e das entalpias das substâncias
envolvidas na equação química de decomposição do nitrato
de amônio, mostradas na tabela, é correto afirmar:
. A partir dessas informações e das entalpias das substâncias
envolvidas na equação química de decomposição do nitrato
de amônio, mostradas na tabela, é correto afirmar: