Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
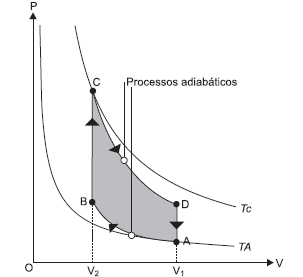
A figura representa o Ciclo de Otto, um ciclo termodinâmico que idealiza o funcionamento de motores de combustão interna de ignição por centelha.
Considerando-se os gases resultantes da combustão como gases ideais e as etapas de transformação apresentadas no diagrama pressão-volume, é correto afirmar:
( ) A densidade da gasolina permanece constante no intervalo térmico entre 25 ºC e 68,7 ºC, nas condições normais de pressão.
( ) A densidade da mistura de massas iguais de gasolina e de etanol, a 20 ºC, é, aproximadamente, 7,7.102 kg/m3 .
( ) Um carro com tanque de capacidade 60 litros pode ser abastecido com 50,0 litros de gasolina a 20 ºC e estacionado ao Sol até atingir a temperatura de 35 ºC, sem que o combustível transborde.
( ) O volume de 1,0m3 de etanol necessita de 7,44.106 J de energia para que vaporize.
A alternativa que indica a sequência correta, de cima para baixo, é a
Cd(s) + NiO2(s) + 2H2O(l) → Cd(OH)2(s) + Ni(OH)2(s).
Considere as seguintes afirmações a respeito dessa reação:
I. O cádmio se oxida.
II. O dióxido de níquel é o agente redutor.
III. O cádmio é o agente oxidante.
IV. O número de oxidação do níquel varia de +4 para +2.
Está correto o que se afirma em

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Apressão de vapor é uma importante propriedade físico-química das substâncias e das soluções.
Com base nos dados fornecidos e nos conhecimentos de química, é correto afirmar:
Observe o esquema:

Semirreações do processo: • ânodo: H2 → 2 H+ + 2e– • cátodo: O2+ 4 H+ + 4e– → 2 H2O
Sobre a célula de hidrogênio esquematizada, é correto afirmar que
 + 3O2(g) → 2CO2 (g) + 3H2O
+ 3O2(g) → 2CO2 (g) + 3H2O  ΔH = - 1366,8kJ
ΔH = - 1366,8kJ + 25/2 O2(g) → 8 CO2(g) + 9 H2O
+ 25/2 O2(g) → 8 CO2(g) + 9 H2O  ΔH = –5 461,0 kJ
ΔH = –5 461,0 kJDadas as entalpias de formação dos compostos:
CO2(g) ΔHf = - 393 kJ/mol
H2O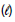 ΔHf = - 286 kJ/mol
ΔHf = - 286 kJ/mol
conclui-se, corretamente, que a entalpia de formação do combustível presente em I é, em kJ/mol,
A2 + B2 → 2 AB
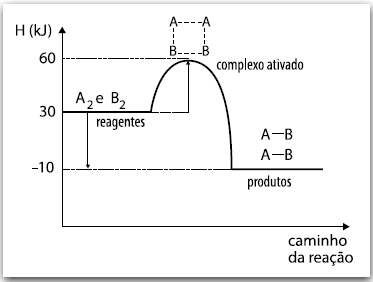
A análise do gráfico permite concluir corretamente que
Considere as reações:
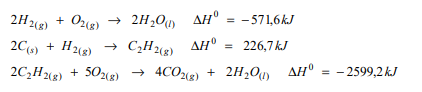
Assinale a entalpia padrão de formação do dióxido de carbono em kJ mol–1
.
Considere a tabela a seguir dos potenciais padrão de redução, em solução a 298 K:
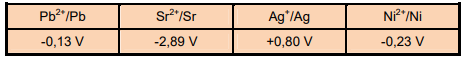
A pilha produzida a partir dos pares redox da tabela, que apresenta a maior diferença de potencial, é a pilha de
reação total:
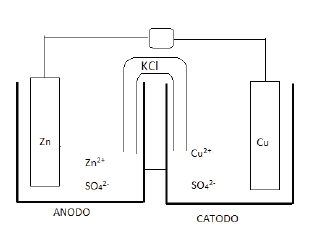
Analise as afirmações a seguir em relação ao funcionamento dessa pilha:
I. No anodo ocorre a oxidação do zinco e no catodo a redução do cobre. II. A carga do anodo é positiva e a do catodo negativa. III. O fluxo de elétrons ocorre do anodo para o catodo através do circuito externo. IV. Na placa de zinco, ocorre corrosão, liberando íons Zn2+ para a solução, enquanto que, na placa de cobre, ocorre deposição de Cu metálico. V. A função da ponte salina é balancear as cargas, sendo que os cátions K+ migram para a solução de sulfato de zinco e os ânions Cl- migram para a solução de sulfato de cobre. VI. O potencial padrão dessa pilha é 1,10 volts. VII. O Zn2+ é o agente oxidante e o Cu2+ é o agente redutor.
A alternativa que indica todas as afirmações CORRETAS é:
Considere o diagrama energético de uma reação:
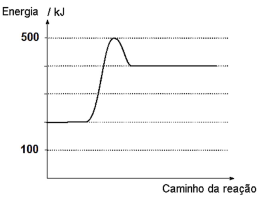
A energia de ativação e a variação de entalpia da reação são, respectivamente, iguais a:
2 Ag(s) + Cu2+➡ 2Ag1+ + Cu(s).
Considerando as semirreações Ag1+➡ Ag(s) e Cu2+➡ Cu(s) , bem como os potenciais de redução E0 = 0,80 V e E0 = 0,34 V, marque a alternativa que preenche adequadamente as lacunas da frase a seguir.
É correto afirmar-se que a pilha tem ddp de _____________ volts, e a reação no sentido indicado é ______________.