Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
Considere a equação termoquímica abaixo representada:
S(g) + 3/2 O2(g) -> SO3(s)
∆H= -94,4 kcal/mol
Podemos afirmar que, na formação de 200 g de trióxido de enxofre:
Equação 1
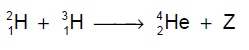
Equação 2

Em relação às equações, assinale a alternativa incorreta:
O isótopo 90Sr é um dos radioisótopos mais perigosos espalhados pelo acidente de Chernobyl porque pode substituir o cálcio em nossos ossos. Sua meia-vida é de, aproximadamente, 28 anos. Para que 1,0 g desse isótopo se reduza a 125,0 mg, deverão transcorrer:
Observe a pilha eletroquímica representada no esquema a seguir:
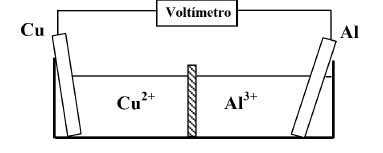
Dados: Al3+/Al = - 1,66V
Cu2+/Cu= +0,34V
Sobre o seu funcionamento, assinale a opção
incorreta.
marque a alternativa verdadeira.
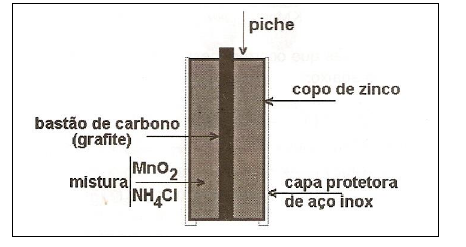 Figura 1: Esquema de uma pilha comum
Figura 1: Esquema de uma pilha comum Quando a pilha está em uso, ocorre a reação química representada pela equação abaixo, resultando na produção de corrente elétrica. Zn + 2NH4+ + 2MnO2 → 2MnO(OH) + Zn2+ + 2NH3
Em função das informações dadas, assinale a alternativa CORRETA.
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
Os extintores de incêndio à base de espuma contêm soluções aquosas de sulfato de alumínio e bicarbonato de sódio. Sobre a chama ocorre a reação cuja equação não balanceada é:
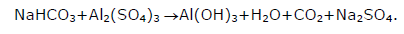
Com relação a reação anterior e seus efeitos
sobre a chama, assinale a afirmação FALSA.
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
(I) H2O(l) → H2(g) + 1/2O2(g) ∆H = +286 kJ (II) H2(g) + ½ O2(g) → H2O(g) ∆H = - 242 kJ (III) H2O(l) → H2O(s) ∆H = - 7,3 kJ
De acordo com as equações acima e os seus conhecimentos de química, é incorreta a afirmativa:
O nitrato de potássio é um composto químico sólido, bastante solúvel em água, muito utilizado em explosivos, estando presente na composição da pólvora, por exemplo. Uma equação termoquímica balanceada para a queima da pólvora é representada abaixo:
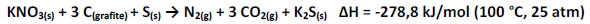
Assinale a alternativa que representa a interpretação correta da equação termoquímica para a queima da pólvora:
A pilha de mercúrio é popularmente conhecida como pilha em forma de “botão” ou “moeda”, muito utilizada em calculadoras, controles remotos e relógios. Nessa pilha existe um amálgama de zinco (zinco dissolvido em mercúrio), óxido de mercúrio (II), e o eletrólito é o hidróxido de potássio. A partir das semirreações de redução do zinco e do mercúrio e seus respectivos potenciais padrão de redução, mostrados no quadro abaixo, assinale a alternativa que represente a pilha de mercúrio corretamente:

Os banhos eletrolíticos que fazem revestimento metálico têm uma sequência: uma peça para ser cromada necessariamente precisa ser primeiro cobreada, depois niquelada e, por fim, receber uma camada de crômio. [...] A deposição eletrolítica pode levar à produção de peças prateadas e douradas, além de outras onde ocorre estanhagem, cadmiagem e latonagem.
(LUFTI, M. Os ferrados e os cromados, produção social e apropriação privada do conhecimento químico. 2ºed. Ijuí: Ed. Unijuí, 2005. p. 110.)
Sobre o processo descrito acima, assinale a alternativa CORRETA:
Considere a reação entre gás cloro e gás hidrogênio mostrada a seguir e ocorrendo em um sistema fechado:
Cl2(g) + H2(g) <-> 2HCI(g)
Dado: Constante dos gases (R) = 0,082 L.atm.mol-1.K-1.
Sobre esse processo, assinale a alternativa CORRETA:
Os efeitos globais gerados pela poluição advinda da queima de combustíveis fósseis tem levado à urgente necessidade por fontes alternativas de energia. Nesse contexto, o etanol (C2 H6O) e o gás hidrogênio (H2) emergem como possíveis substitutos da gasolina (C8 H18). A seguir estão apresentadas as reações de combustão de cada uma dessas espécies e os respectivos valores de entalpia padrão (25 ºC):
(Dadas as massas molares em g/mol: H=1, C=12, O=16)
C8
H18 + 12,5 O2 -> 8 CO2
+ 9 H2O
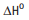 = –5471 kJ/mol
= –5471 kJ/mol C2
H6O + 3 O2 -> 2 CO2
+ 3 H2O
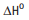 = –1368 kJ/mol
= –1368 kJ/mol H2
+ ½ O2 -> H2O
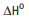 = –286 kJ/mol Com base nessas informações, pode-se afirmar que:
= –286 kJ/mol Com base nessas informações, pode-se afirmar que: H2CO3(aq) + Ca(OH)2(aq) → CaCO3(s) + 2 H2O(l) Equação 1
São apresentadas as entalpias-padrão de reação, em kJmol-1 , para três reações a 25oC:
I - CaO(s) + CO2(g) → CaCO3 (s) ΔH° = -183,3 kJmol-1 Equação 2 II - CaO (s) + H2O(l) → Ca(OH)2(aq) ΔH° = - 82,4 kJmol-1 Equação 3 III - CO2 (g) + H2O(l) → H2CO3(aq) ΔH° = - 20,5 kJmol-1 Equação 4
O valor da entalpia-padrão, em kJ, para a produção do carbonato na reação da equação 1 é:
Cu(s) | Cu2+ (1 M) | | Ag+ (1 M) | Ag(s)
Considerando os potenciais de redução: Cu2+ = + 0,337 V e Ag+ = + 0,779 V, pode-se afirmar que
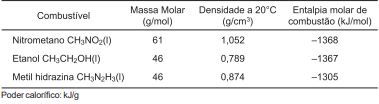
A tabela apresenta os valores de densidades, massa molar e entalpia molar de combustão de alguns combustíveis.
Considerando-se essas informações e com base nos conhecimentos de termoquímica, é correto afirmar:
O gás hidrogênio é muito utilizado em diversos processos industriais, tais como: síntese de amônia, hidrogenação de óleos e gorduras, etc. Uma das formas utilizadas para a produção do gás hidrogênio é a partir da reação de reforma do metano. Este processo, em condições adequadas, ocorre através de duas reações representadas pelas equações 1 e 2, já a equação 3 representa a reação global deste processo.
Equação 1: CH4(g) + H2O(g) → CO(g) + 3H2(g) ∆ H = +206 kJ
Equação 2: CO(g) + H2O(g) → CO2(g) + H2(g) ∆ H = - 41 kJ
Equação 3: CH4(g) + 2H2O(v) → CO2(g) + 4H2(g)
Dados: Massas molares (g.mol-1): C = 12, H = 1, O = 16
Sobre as substâncias e as reações representadas por estas equações é incorreto afirmar que:

