Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
ENGENHEIRAS DO CHILE CRIAM TECNOLOGIA QUE
RECARREGA BATERIAS COM PLANTAS
Uma tecnologia vinda do Chile pode ser uma alternativa curiosa para a recarga de dispositivos eletrônicos: com ela, em vez de ir atrás de uma tomada, você precisa procurar uma planta.
Trata-se do projeto E-Kaia, que começou como um trabalho universitário de três amigas e se transformou em uma startup que já acumula prêmios mesmo sem o produto no mercado. O E-Kaia captura energia de plantas utilizando uma “placa de biocircuitos” e só precisa ser “enterrado” em um local de cultivo de uma planta bem cuidada. Aparentemente, o sistema recupera energia restante da fotossíntese e é capaz de fornecer 5 volts a 0,5 ampere.
O grupo afirma que a planta também não apresentou problemas de crescimento ou atraiu fungos e pragas. Gadgets e LEDs de baixo consumo podem receber a energia, embora a velocidade de recarga não tenha sido divulgada.
Disponível em: http://www.tecmundo.com.br/bateria/85844-engenheiraschile-criam-tecnologia-recarrega-baterias-plantas.htm. Acesso em: 13 de setembro de 2015. Adaptado.
[Dados: M(Cu) = 63,5 g/mol; 1F = 96500 C/mol de elétrons.]
De acordo com o texto, qual a massa máxima de cobre que pode ser depositada após 38600 s de processo eletrolítico?
Também conhecido como gás natural ou gás dos pântanos, o metano é um gás representado pela fórmula química CH4, incolor, de odor fraco a levemente adocicado, altamente inflamável, estável, praticamente insolúvel em água e solúvel em solventes orgânicos (álcoois, benzenos, ésteres e gasolina). Trata-se do composto mais simples e abundante do grupo dos hidrocarbonetos. O metano se forma a partir da fermentação de resíduos orgânicos pela ação de bactérias, como a decomposição do lixo orgânico nos aterros sanitários, a emissão de vulcões de lama, a digestão de herbívoros, a extração de combustível mineral, o metabolismo de certas espécies bacterianas, o apodrecimento de vegetais nos pântanos (sendo, por isso, chamado de gás dos pântanos), entre outros processos. Por esse motivo, nos aterros sanitários, são colocadas muitas “chaminés”, que atravessam as várias camadas de material, pelos quais escoam os gases formados pela fermentação do lixo.
Disponível em: http://www.infoescola.com/compostosquimicos/metano/.
Acesso em: 16 de agosto de 2015.
Dados:
C(graf.) + O2(g) → CO2(g) ∆H = – 393,5 kJ/mol
H2(g) + 1/2 O2(g) → H2O(ℓ) ∆H = – 285,8 kJ/mol
CH4(g) + 2O2(g) → CO2(g) + 2H2O(ℓ) ∆H = – 889,5 kJ/mol
A análise dos dados apresentados permite inferir que o
calor de formação do metano é
Uma substância muito usada na produção de compressas frias (BOLSAS DE FRIO INSTANTÂNEO) é o nitrato de amônio sólido. Ao ser dissolvido em água, há uma queda brusca na temperatura do sistema, chegando a uma temperatura de – 5,6 °C, aproximadamente, sem que haja solidificação do líquido.
A equação química representativa do processo é:
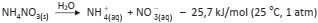
Disponível em: Química: ações e aplicações: 2ª série/Vera Lúcia Duarte de
Novais – 1ª ed. –
São Paulo: FTD, 2013. Adaptado.
De acordo com a termodinâmica, é pertinente inferir que
ARMÊNIA: BALÕES DE HÉLIO EXPLODEM
EM COMÍCIO E FEREM 140
Mais de 140 pessoas, em sua maioria menores de idade, ficaram feridas [...] durante um comício eleitoral na capital da Armênia devido à explosão de diversos balões de hélio nas vésperas das eleições parlamentares [...].
Os motivos da explosão dos balões de propaganda eleitoral ainda são desconhecidos. No entanto, algumas fontes mencionaram que foram causados por cigarros. [...]

Balões de hélio explodem em um comício do Partido
Republicano antes das eleições parlamentares, em Yerevan
Disponível em: http://noticias.terra.com.br/mundo/armenia-baloes-dehelio-explodem-em-comicio-e-ferem140,e09cff0df bada310VgnCLD 200000bbcceb0aRCRD.html. Acesso em: 15 de agosto de 2015.
A notícia retrata um fato recorrente em reuniões
comemorativas. Relacionado ao acontecido, é pertinente
inferir que
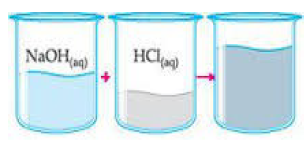
Ao se misturar 100 mL de HCl 1/mol/L com100 mL de NaOH de mesma concentração,obtém-se uma solução de NaCl (sal de cozinha) e observa-se claramente um aumento de temperatura.
Diante do exposto, pode-se afirmar que se trata de uma reação
O isótopo radioativo 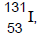 , que possui meia-vida de
oito dias, é utilizado no diagnóstico e no tratamento de
problemas da tireoide. Se 10 mg de iodo-131 recémproduzido foi administrado a um paciente, quantos
miligramas estarão ainda presentes no seu organismo
após 32 dias?
, que possui meia-vida de
oito dias, é utilizado no diagnóstico e no tratamento de
problemas da tireoide. Se 10 mg de iodo-131 recémproduzido foi administrado a um paciente, quantos
miligramas estarão ainda presentes no seu organismo
após 32 dias?
Com base no exposto, deduz-se que as reações químicas envolvidas no endurecimento do concreto:

Nesse contexto, o número de massa e o número de prótons de X são, respectivamente:
Jornal o Estado do Maranhão. Adaptado.
Suponha que determinada gasolina seja composta de hidrocarbonetos com fórmula (C8H18). Nessas condições, as equações químicas que representam as reações de combustão completas do etanol e do octano, devidamente balanceadas, permitem afirmar que a combustão de
A VLI, empresa especializada em operações logísticas, além de incentivar por meio do projeto “Trilhos Culturais – Jovens multiplicadores” a difusão de diversos conhecimentos em comunidades que ficam às margens das linhas férreas brasileiras, a promoção e a participação social em ações educativas, incluiu em suas atividades o transporte de manganês, pelo corredor Centro Norte. Este metal apresenta vários estados de oxidação em diferentes espécies, como por exemplo, MnCO3, MnF3, K3MnO4 e MnO4 -2 . O manganês é transportado da cidade paraense, Marabá, até o porto do Itaqui, passando pela estrada de ferro Carajás, e segue em navios para outras cidades do litoral brasileiro, como também, para a Europa, Ásia e Estados Unidos.
Jornal o Estado do Maranhão.
Os números de oxidação do manganês nas espécies relacionadas, no texto, respectivamente, são
I. Zn(s) + 2OH− (aq) → ZnO(s) + H2O(l) + 2e− , E° = +1,26 V
II. 2MnO2(s) + H2O(l) + 2e− → Mn2O3(s) + 2OH− (aq), E° = +0,26 V
É correto afirmar sobre as pilhas alcalinas:
1) A reação (I) ocorre no ânodo; a reação (II) ocorre no cátodo.
2) A concentração do eletrólito alcalino (KOH) é mantida constante.
3) O potencial de cela (∆E°) desenvolvido através da célula eletroquímica, envolvendo as duas reações (I e II), será de +1,52 V.
Está(ão) correta(s) a(s) afirmativa(s):
C6H12O6(s) + 6 O2 (g) → 6 CO2(g) + 6 H2O(l)
Calcule a entalpia padrão de combustão da glicose sabendo as entalpias padrão de formação:
∆Hf°(C6H12O6,s) = −1.268 kJ∙mol−1 ∆Hf°(CO2,g) = −393,51 kJ∙mol−1 ∆Hf°(H2O,l) = −285,83 kJ∙mol−1
H2(l) + ½ O2(l) → H2O(g), ∆H = -242 kJ.mol-1
Levando-se em consideração a aplicação, e que todo o combustível é consumido, qual é a energia (J) liberada para propulsão do ônibus espacial?
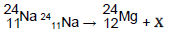
para completar a equação dessa reação nuclear, a espécie X deve ser:

(www.emsintese.com.br)
Nesse experimento, ocorre uma reação de oxirredução, na qual
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
1. Colocou-se 30 mL de água destilada em um béquer de capacidade de 100 mL.
2. Adicionou-se, neste mesmo béquer, 30 mL de álcool isopropílico.
3. Com um bastão de vidro, fez-se agitação na solução.
4. Em seguida, mergulhou-se uma cédula de R$ 100,00 no béquer contendo a solução, e deixou-se que a cédula embebesse a solução por dois minutos.
5. Com uma pinça de madeira, retirou-se a cédula do béquer pinçando-a por uma das pontas.
6. A cédula foi então submetida à chama de uma vela, para que ela queimasse; essa ação permitiu a combustão do álcool isopropílico.
7. Observou-se em seguida que, apesar de a cédula ter sido submetida ao fogo da chama da vela, ela não queimou, ficando da mesma forma que estava antes da experiência.
Com relação a essa experiência, assinale a afirmação verdadeira.
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
