Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
Em abril de 1898, Marie Sklodowska Curie (1867-1934) e Pierre Curie (1859-1906), ao processar a pechblenda obtiveram duas frações radioativas. Uma delas apresentou uma radioatividade 400 vezes maior que a do urânio. O casal Curie associou essa radioatividade a um novo elemento químico, o qual foi denominado polônio, em homenagem à Polônia, terra natal de Marie Curie. O polônio foi o terceiro elemento radioativo identificado, depois do urânio e do tório, o que levou Marie Curie a receber o Prêmio Nobel de Química em 1911.
Na natureza há sete isótopos naturais do polônio, representados por: 210Po, 211Po, 212Po, 214Po, 215Po, 216Po e 218Po. Todos os isótopos desse elemento desintegram-se por emissão de partículas alfa, produzindo isótopos de chumbo. A elevada energia das partículas alfa emitidas pelo polônio permite a identificação de diminutas quantidades desse elemento em uma amostra. O polônio se dissolve em ácidos diluídos produzindo soluções contendo íons Po2+ .
Considere as informações acima e assinale a proposição CORRETA.
Sabendo que a meia-vida do isótopo 210Po é de aproximadamente 140 dias, após 40
semanas o percentual desse isótopo na natureza será igual a 12,5%.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Na recarga, a liga metálica absorve hidrogênio.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Nas baterias de hidreto metálico, o hidrogênio é o polo positivo.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Na semirreação catódica, ocorre diminuição do número de oxidação do níquel.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Após a utilização, baterias de níquel-cádmio devem retornar aos revendedores para
destinação ambientalmente adequada.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Baterias secundárias são geradores de energia elétrica, do tipo não recarregável.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Durante o funcionamento das baterias de hidreto metálico, o número de oxidação do
hidrogênio permanece constante, igual a +1.
Algumas baterias secundárias ainda comercializadas no país contêm metal altamente tóxico, como as baterias de níquel-cádmio. Avanços tecnológicos permitiram a obtenção de baterias de hidreto metálico, com maiores taxas de energia armazenada e menor risco ambiental, cujo material ativo do ânodo é o hidrogênio absorvido na forma de hidreto metálico, em vez de cádmio. Durante a descarga, o hidreto metálico reage regenerando o metal, que na realidade é uma liga metálica. O funcionamento das baterias de hidreto metálico compreende as seguintes etapas:
Semirreação anódica: MH(s) + (OH)- (aq) → M(s) + H2O(ℓ) + e-
Semirreação catódica: NiOOH(s) + H2O(ℓ) + e- → Ni(OH)2(s) + OH(aq)
Com base nas informações acima, assinale a proposição CORRETA.
Nas baterias de hidreto metálico, o material ativo é o agente oxidante.

Observação: Algumas das questões desta prova são adaptações de situações reais. Alguns
dados e condições foram modificados para facilitar o trabalho dos candidatos.
Pedrinho, ao chegar da escola, explica para sua avó o que aprendeu sobre o funcionamento de uma panela de pressão. Ela ficou surpresa em saber como um utensílio doméstico comum serve para exemplificar e explicar muitos princípios físicos.
Independentemente de marca e modelo, além de cabos e tampa, toda panela de pressão é constituída basicamente de uma válvula com pino, que serve para controlar a pressão dentro da panela, e de uma válvula de segurança que se rompe, caso a válvula com pino não seja acionada.
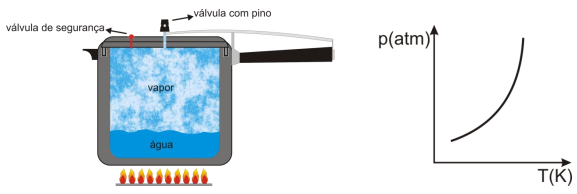
Com base no funcionamento da panela, nos princípios e fenômenos físicos envolvidos e no diagrama de fase acima, assinale a proposição CORRETA.
Na panela de pressão em contato com a chama, ocorre uma transformação isobárica
quando a válvula com pino é acionada.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
A película escura, Ag2S, tem duplo papel, funcionando como agente redutor e como oxidante,
pois forma Ag0
e S2-
.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
A semirreação, já balanceada, de deposição da prata na superfície da peça, pode ser
representada como: 3Ag2S(s) + 6e-
→ 6Ag(s) + 3S2-
.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
O papel alumínio é apenas um protetor da peça de prata porque o agente redutor, neste caso,
é o bicarbonato de sódio, que se oxida e forma o dióxido de carbono como um dos produtos.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
À medida que a reação ocorre, uma pequena quantidade de alumínio na folha é oxidada,
dissolvendo-se na solução.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
A folha de papel alumínio, menor potencial de redução, é o catodo e a peça de prata é o
anodo.
Objetos de prata ficam enegrecidos por ação de H2S proveniente do ar (poluente atmosférico) ou de alimentos (ovo, cebola etc.). A película escura formada, Ag2S, nestes objetos, é geralmente removida por polimento utilizando pastas limpadoras comerciais contendo abrasivos suaves. O uso constante dessas pastas na manutenção do brilho em objetos de prata resultará, obviamente, num desgaste dessas peças. Uma maneira bem caseira de remover a película escura sem desgastar pratarias é envolver (embrulhar) a peça de prata em uma folha de papel alumínio e em seguida imergi-la em um banho de solução aquosa diluída de bicarbonato de sódio (NaHCO3) levemente aquecida. Após certo tempo a peça de prata é retirada do banho e do invólucro de alumínio, lavada com água corrente, enxuta delicadamente e o brilho característico é restaurado.
De acordo com o texto acima, assinale a proposição CORRETA.
A maneira caseira de remover películas escuras de pratarias representa um exemplo de célula
galvânica.
Um indicador de poluição difusa de água subterrânea é o nitrato. Sua origem está relacionada a atividades agrícolas e esgotos sanitários. Sendo o nitrato uma forma estável de nitrogênio em condições anaeróbias, esta substância pode ser considerada persistente e sua remoção da água, para atender ao padrão de potabilidade que é de 10 mg/L, é onerosa e, por vezes, tecnicamente inviável, prejudicando o abastecimento público e privado.
Disponível em: <http://www.cetesb.sp.gov.br/Solo/agua_sub/poluicao.asp> Acesso em: 03 set. 2010. (Adaptado)
Considere as seguintes reações utilizadas para a determinação de nitrato.
Sobre o assunto e as reações acima, assinale a proposição CORRETA.
Na primeira reação ocorre a conversão de nitrato para nitrito.
Um indicador de poluição difusa de água subterrânea é o nitrato. Sua origem está relacionada a atividades agrícolas e esgotos sanitários. Sendo o nitrato uma forma estável de nitrogênio em condições anaeróbias, esta substância pode ser considerada persistente e sua remoção da água, para atender ao padrão de potabilidade que é de 10 mg/L, é onerosa e, por vezes, tecnicamente inviável, prejudicando o abastecimento público e privado.
Disponível em: <http://www.cetesb.sp.gov.br/Solo/agua_sub/poluicao.asp> Acesso em: 03 set. 2010. (Adaptado)
Considere as seguintes reações utilizadas para a determinação de nitrato.
Sobre o assunto e as reações acima, assinale a proposição CORRETA.
A primeira reação é de oxirredução onde o nitrogênio é oxidado.
Em uma indústria do Estado de São Paulo que produz ácido sulfúrico 98% a partir da queima de enxofre elementar, com capacidade de produção inicial de 600 toneladas por dia, ocorreu uma emissão de gás dióxido de enxofre (SO2). Essa emissão de gás ultrapassou as fronteiras da fábrica de ácido sulfúrico e atingiu a população do entorno. Várias pessoas apresentaram agravos à saúde relacionados ao caso, como irritação das vias aéreas, desmaios, vômitos e enjoos, demandando atendimento hospitalar de emergência em hospitais da região. Também foram acionados o Serviço de Atendimento Médico de Urgência (SAMU) e o Corpo de Bombeiros.
JÚNIOR, L.M.; LORENZI, R.L. Revista brasileira de saúde ocupacional. São Paulo: 32(116): 31-37, 2007. (Adaptado)
Sobre o assunto, é CORRETO afirmar que:
o SO2 deve ser oxidado a SO3 durante o processo de produção do ácido sulfúrico.
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Uma reação endotérmica pode se tornar exotérmica na presença de um catalisador.

Considerando-se o valor da constante de Faraday 96.500 C, conhecendo-se os potenciais de redução para as semirreações que ocorrem na pilha, Sn/Sn2+ // Pb2+/Pb, cujas concentrações de Sn e Pb valem, respectivamente, 1,0 M e 10-3 M, e sabendose, ainda, que:
Sn2++ 2e-→ Sn Eo= - 0,14 V Pb2+ + 2e-→ Pb E = - 0,22 V,
pode-se afirmar corretamente que a reação global da pilha