Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
C6H12O6(s) + 6 O2(g)
 6 CO2(g) + 6 H2O(l)
6 CO2(g) + 6 H2O(l)
Sabendo os valores de entalpia (∆H = −2.805 kJ.mol−1) e entropia (∆S = 259 J.mol−1.K−1), à temperatura ambiente (25°C = 298 K), determine a energia livre de Gibbs (∆G) para esta reação e indique se a reação é espontânea ou não
C6H12O6(s) → 2 C2H5OH(l) + 2 CO2(g) ∆H°= −74,0 kJ.mol−1
Calcule a quantidade de glicose, em gramas, a ser fermentada para produzir 300 kJ de calor.
Dados: Massas molares em g.mol−1: H = 1; C = 12; O = 16.
I2(s) + 2 e- → 2 I- (aq) E0 = +0,54 V
Li+ (aq) + e- → Li(s) E0 = -3,05 V
Com base nas reações de redução acima, foram realizadas as seguintes afirmações:
1) a ddp da bateria do marcapasso é de -3,59 V. 2) o Li(s) é considerado um forte agente redutor. 3) o I2 apresenta potencial de redução mais positivo que o Li+ , por isso, numa célula galvânica deve sofrer oxidação.
Está(ão) correta(s):
Dado: massa molecular do metano = 16 g.mol-1.
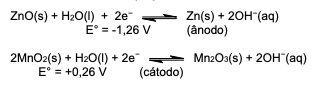
Qual é o potencial de célula (ΔE°) desenvolvido entre os polos positivo e negativo da pilha alcalina?
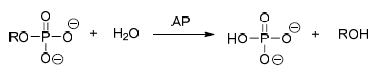
Considere as afirmações e assinale a alternativa correta.
Admita uma solução aquosa de sulfato de ferro(II) que passou por um processo de eletrólise durante duas horas, empregando-se uma corrente elétrica com intensidade (i) de 5 A, e a semirreação a seguir:
Fe2 + (aq) + 2e- → Fe(s)
Considerando a Constante de Faraday = 96 500 C/mol, 1 hora = 3 600 s e massa molar do ferro (Fe) = 56 g/mol, a massa aproximada de ferro metálico que pode ser depositada no cátodo, nessas condições, é
Compressas de emergência quentes são usadas como primeiro socorro em contusões sofridas em práticas esportivas. Essa compressa constitui-se de um saco de plástico contendo uma ampola de água e um produto químico seco, por exemplo, o cloreto de cálcio (CaCℓ2 ). Com uma leve pancada, a ampola se quebra e o cloreto de cálcio se dissolve, conforme a reação representada pela equação:
CaCℓ2 (s) + H2 O (ℓ) → CaCℓ2 (aq) ∆H = −82,7 kJ/mol
Nesse processo,
Dados: Mn +2 + 2e ⇾ Mnº Eº = -1,18v Zn +2 + 2e º ⇾ Znº Eº = -0,76v
I. H2(g) + O2(g) ⇾ H2O(l) ΔH = -68 Kcal/mol II. C(g) + O2(g) ⇾ CO2(g) ΔH = -94 Kcal/mol III.C2H5OH(l) + O2(g) ⇾ CO2(g) + H2O(l) ΔH = -327 Kcal/mol
A entalpia de formação do etanol será:
Durante a última parte da viagem, Eduardo pega um pacote contendo 40g de biscoito e lê o rótulo. A tabela que Eduardo vê foi adaptada e está representada a seguir:
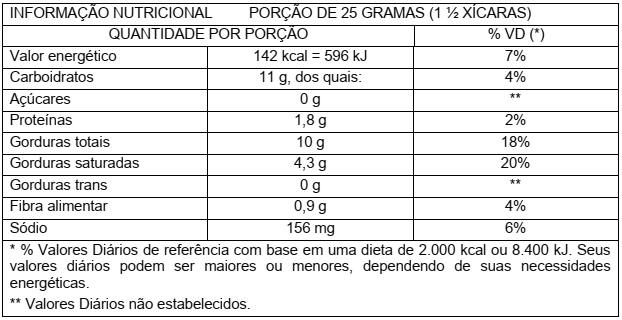
Considere que o total de gordura refere-se apenas a triglicerídeos. Com base nas informações acima, assinale a proposição CORRETA.
Segundo o rótulo do produto, seriam necessários mais de 30 pacotes de biscoito para suprir
a necessidade energética.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Em contato com a água, o sódio metálico reage gerando um forte aquecimento, fenômeno
típico de uma reação endotérmica.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Na reação representada pela equação I, o sódio se oxida e o nitrogênio se reduz.
Depois de terem percorrido cerca de 80 km, os dois amigos param para abastecer o carro. Após o abastecimento, Carlos tenta dar partida no veículo, porém nada acontece. Como o carro tem mais de 20 anos, ele não se surpreende e desce do mesmo para dar uma olhada. Ao abrir o capô, percebe que há um acúmulo de material azul esverdeado (zinabre) envolvendo os eletrodos da bateria.
Dado: o zinabre é uma mistura de CuCO3 e Cu(OH)2.
Sobre o assunto, é CORRETO afirmar que:
para remover o zinabre do eletrodo seria adequado utilizar uma solução básica.
Depois de terem percorrido cerca de 80 km, os dois amigos param para abastecer o carro. Após o abastecimento, Carlos tenta dar partida no veículo, porém nada acontece. Como o carro tem mais de 20 anos, ele não se surpreende e desce do mesmo para dar uma olhada. Ao abrir o capô, percebe que há um acúmulo de material azul esverdeado (zinabre) envolvendo os eletrodos da bateria.
Dado: o zinabre é uma mistura de CuCO3 e Cu(OH)2.
Sobre o assunto, é CORRETO afirmar que:
a reação entre o dióxido de carbono e o óxido de cobre (II) envolve um processo de
oxirredução.
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes informações:
Expressão de equilíbrio:
H2C 
Dados termodinâmicos (a 298 K):
Keq=7,5 x 107
∆H0 = -84,1 kJ mol-1
Ea= 140 kJ mol-1

O fato da reação apresentar ∆H<0 indica que a velocidade de obtenção do CH3CH2Br é alta.
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes informações:
Expressão de equilíbrio:
H2C 
Dados termodinâmicos (a 298 K):
Keq=7,5 x 107
∆H0 = -84,1 kJ mol-1
Ea= 140 kJ mol-1

Com relação às informações acima, assinale a proposição CORRETA.
O valor de ∆H sugere que a reação é endotérmica.
Em abril de 1898, Marie Sklodowska Curie (1867-1934) e Pierre Curie (1859-1906), ao processar a pechblenda obtiveram duas frações radioativas. Uma delas apresentou uma radioatividade 400 vezes maior que a do urânio. O casal Curie associou essa radioatividade a um novo elemento químico, o qual foi denominado polônio, em homenagem à Polônia, terra natal de Marie Curie. O polônio foi o terceiro elemento radioativo identificado, depois do urânio e do tório, o que levou Marie Curie a receber o Prêmio Nobel de Química em 1911.
Na natureza há sete isótopos naturais do polônio, representados por: 210Po, 211Po, 212Po, 214Po, 215Po, 216Po e 218Po. Todos os isótopos desse elemento desintegram-se por emissão de partículas alfa, produzindo isótopos de chumbo. A elevada energia das partículas alfa emitidas pelo polônio permite a identificação de diminutas quantidades desse elemento em uma amostra. O polônio se dissolve em ácidos diluídos produzindo soluções contendo íons Po2+ .
Considere as informações acima e assinale a proposição CORRETA.
Emissões alfa são partículas negativas de massa muito pequena.