Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
LIMA, M. E. C. C.; DAVID, M. A.; MAGALHÃES, W. F de. Ensinar Ciências por investigação: um desafio para os formadores. Química Nova na Escola, n. 29, ago. 2009. p. 25. Adaptado.
De acordo com o texto, marque a alternativa que apresenta uma informação INCORRETA sobre o que ocorre na bolsa térmica.
No gráfico a seguir, é apresentada a variação da energia durante uma reação química hipotética.
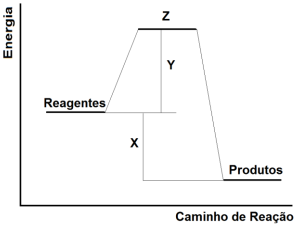
Com base no gráfico, pode-se correlacionar X, Y e Z, respectivamente, como
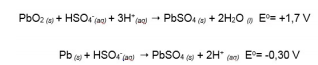
Analise as alternativas abaixo selecionadas com as semi-reações (1) e (2). I. Na Equação 1, é onde ocorre a reação de oxidação, e na Equação 2 a reação de redução. II. A Equação 1 pode ser identificada como anodo e a Equação 2 o catodo. III. No processo eletroquímico, estão envolvidos 2 mols de elétrons. IV. O chumbo é agente redutor e, também, agente oxidante. V. A célula voltaica gera 2 Volts.
Está incorreto o que se afirma em
CaO(s) + H2O(l) → Ca(OH)2 + 63,7 kJ
afirma-se que temos uma reação
CaCO3(s)
 CaO(s) + CO2(g)
CaO(s) + CO2(g)
Que volume de CO2 será obtido, considerando o rendimento reacional de 80%?
Al+ 3 + 3e → Al (-1,66 V) Fe+2 + 2e → Fe (-0,44 V),
a ddp da pilha Al ; Al+3 ; Fe+2 ; Fe, em condições - padrão, é:
O carbonato de cálcio (CaCO3) é, recentemente, um dos principais compostos pesquisados na área de materiais, sobretudo em cerâmicas, como na produção de tijolos. Uma das maneiras de produção do CaCO3 é pela reação entre o hidróxido de cálcio, Ca(OH)2, e de ácido carbônico, H2CO3 conforme esta equação:
H2CO3(aq) + Ca(OH)2(aq) → CaCO3(s) + 2 H2O(l) Equação 1
São apresentadas as entalpias-padrão de reação, em kJmol-1 , para três reações a 25°C:
I - CaO(s) + CO2(g) → CaCO3 (s) ΔH° = -183,3 kJmol-1 Equação 2
II - CaO (s) + H2O(l) → Ca(OH)2(aq) ΔH° = - 82,4 kJmol-1 Equação 3
III - CO2 (g) + H2O(l) →H2CO3(aq) ΔH° = - 20,5 kJmol-1 Equação 4
I. Trata-se de um processo endotérmico.
II. Ocorre com liberação de energia para o meio externo.
III. Há a formação de 3 mols de dióxido de carbono e 4 mols de água.
IV. São consumidos 5 mols de gás oxigênio.
Analisando-se as afirmações acima, estão corretas somente
O elemento de número atômico 117 foi o mais novo dos elementos artificiais obtidos em um acelerador de partículas. Recentemente, a IUPAC (União Internacional de Química Pura e Aplicada) anunciou que o nome sugerido para esse novo elemento é Tennessino. Alguns átomos do isótopo 293 desse elemento foram obtidos a partir do bombardeamento de um alvo contendo 13 mg de 249Bk por um feixe de núcleos de um isótopo específico. A reação produziu quatro nêutrons, além do isótopo 293 do elemento de número atômico 117.
• O isótopo que compõe o feixe de núcleos utilizado no acelerador de partículas para a obtenção do Tennessino é melhor representado por
Observe a equação de formação de etanol a seguir:
2 Cgraf + 3 H2(g) + ½ O2(g) → C2 H6 O(l)
Com base nas equações abaixo que resultam na reação de interesse, calcule o ∆H da reação de formação do etanol.
I. Cgraf + O2(g) → CO2(g) ∆H = -394 kJ/mol
II. H2(g) + ½ O2(g) → H2 O(l) ∆H = -286 kJ/mol
III. C2
H6
O(l) + 3 O2(g) → 2 CO2(g) + 3 H2
O(l) ∆H = -1368 kJ/mol
A pilha seca foi inventada e patenteada em 1866 pelo engenheiro francês Georges Leclanché. A pilha de Leclanché é a precursora das pilhas secas modernas, podendo ser utilizadas em lanternas, rádios portáteis, gravadores, brinquedos etc. As reações que ocorrem na pilha seca são as seguintes:
No cátodo:
2 MnO2(s)+2 NH4 + (aq)+2 e−→ Mn2O3(s)+2 NH3 (aq)+ H2O(l) E° = 0,737 V
No ânodo:
Zn → Zn2+ + 2 e− E° = − 0,763 V
Qual é a máxima variação de potencial (ΔE) obtida nesta pilha?
C6H12O6(s) + 6 O2(g) → 6 CO2(g) + 6 H2O(l) + calor
Quando 1 mol de glicose reage, quantos mols de elétrons são transferidos nesta reação redox?
Hb(aq) + CO(aq)
 HbCO(aq) ΔG° = −80 kJ.mol -1 Hb(aq) + O2(aq)
HbCO(aq) ΔG° = −80 kJ.mol -1 Hb(aq) + O2(aq) HbO2(aq) ΔG° = −70 kJ.mol -1
HbO2(aq) ΔG° = −70 kJ.mol -1 De acordo com as equações químicas acima, qual é a variação de energia livre para a reação de substituição do CO ligado à hemoglobina (HbCO) pelo O2?
Sabendo que a reação de combustão da glicina é representada pela equação química:
4 C2H5NO2(s) + 9 O2(g) → 8 CO2(g) + 10 H2O(g) + 2 N2(g)
calcule o calor liberado na reação acima, a 298 K, a partir das entalpias-padrão de formação listadas na Tabela 1.
Tabela 1. Entalpias-padrão de formação, ∆Hf°, a 298 K.
Substância C2H5NO2(s) CO2(g) H2O(l)
∆Hf°(kJ/mol) −533,0 −394 −286
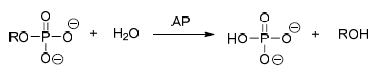
Considere as afirmações e assinale a alternativa correta.
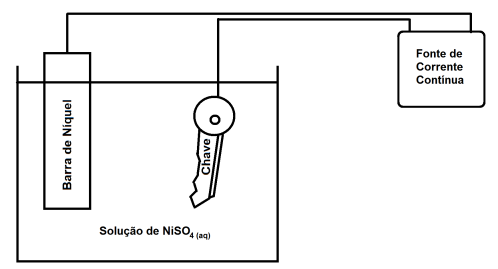
No processo de revestimento da chave com níquel ocorrerá, majoritariamente, uma reação de X, representada por uma semirreação Y. Nesse caso, o par X,Y pode ser representado por