Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
Um aluno mergulhou uma bobina de cobre (6,00 g) em uma solução de nitrato de prata (2,0 g dissolvidos em solução aquosa para 50 mL de volume total). Ele observou, após a ocorrência da reação, a deposição de um sólido acinzentado sobre a bobina de cobre, e também notou que a solução adquiriu uma coloração azul. A massa do sólido cinza foi de 1,2 g e a massa da bobina 5,50 g. As equações abaixo podem ser utilizadas para descrever a reação que ocorre no experimento:
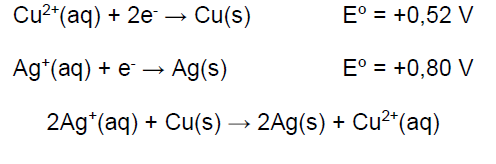
Analise as proposições em relação às informações e às equações acima.
I. A concentração da solução de nitrato de prata é 0,2 mol/L
II. Essa reação pode ser considerada uma pilha com um ΔEº = 0,28 V.
III. A prata oxida nessa reação.
IV. O sólido que se deposita sobre a bobina de cobre é de prata metálica.
V. O cobre é o agente redutor, sofrendo redução.
VI. A quantidade de prata produzida (sólido cinza) foi de 0,011 mol e a quantidade de cobre consumida 0,0079 mol.
Assinale a alternativa correta.
A nitroglicerina - C3H5(NO3)3 – é um nitrato de alquila, descoberta em 1847 por Ascanio Sobrero (químico italiano, 1812-1888), que a obteve misturando glicerina, ácido nítrico e ácido sulfúrico. No estado puro e à temperatura ambiente, a nitroglicerina é um líquido muito explosivo e perigoso. Em 1867, Alfred Nobel (químico sueco, 1833-1896) realizou testes no sentido de melhorar a manipulação da nitroglicerina, misturando-a com materiais inertes, como sílica, pós cerâmicos, argila, gesso, carvão e terras diatomáceas. Esses materiais, agora moldáveis, viriam a se tornar um explosivo muito importante, conhecido como dinamite.
A equação abaixo (não balanceada) representa a reação de decomposição da nitroglicerina:
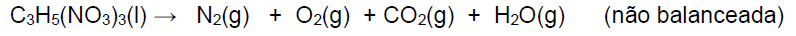
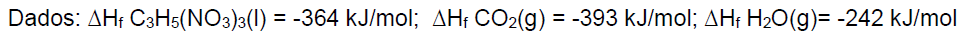
De posse das informações, assinale a alternativa que representa a variação de entalpia da
reação acima, em kJ por mol de nitroglicerina.
A lactose é hidrolisada no leite “sem lactose”, formando dois carboidratos, conforme a equação química:
lactose + água → glicose + galactose
Se apenas os carboidratos forem considerados, o valor calórico de 1 litro tanto do leite integral quanto do leite “sem lactose” é igual a −90 kcal, que corresponde à entalpia-padrão de combustão de 1 mol de lactose.
Assumindo que as entalpias-padrão de combustão da glicose e da galactose são iguais, a entalpia de combustão da glicose, em kcal/mol, é igual a:
Considerando as seguintes semirreações, em uma célula galvânica com eletrodos de alumínio e chumbo, é correto afirmar que
Al3+ + 3e- ⇄ Al0 E0red = -0,13V
Pb2+ + 2e- ⇄ Pb0 E0red = -1,66V
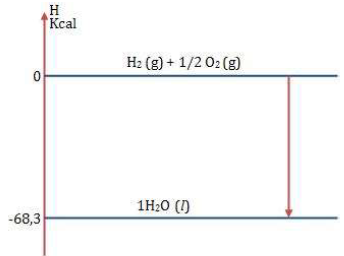
Disponível em: <https://www.colegioweb.com.br/wp-content/uploads/21337.jpg.> Acesso em 30/03/2018.
O esquema ilustra o aspecto energético da reação de formação de água líquida a partir dos gases hidrogênio e oxigênio. Essa reação é uma
No que diz respeito aos ciclos de combustíveis nucleares empregados nos reatores, a expressão “fértil” refere-se ao material que produz um nuclídeo físsil após captura de nêutron, sendo que a expressão “físsil” refere-se ao material cuja captura de nêutron é seguida de fissão nuclear.
(José Ribeiro da Costa. Curso de introdução ao estudo dos ciclos de combustível, 1972. Adaptado.)
Assim, o nuclídeo Th-232 é considerado fértil, pois produz nuclídeo físsil, pela sequência de reações nucleares:
232Th + 1n → 233Th → 233Pa + β–
233Pa → nuclídeo físsil + β–
O nuclídeo físsil formado nessa sequência de reações é o
C6H12O6
 2 C2H5OH + 2 CO2
2 C2H5OH + 2 CO2 Sendo os calores de formação da glicose, do gás carbônico e do álcool, respectivamente, –302, –94 e –66 kcal/mol, pode-se afirmar que a fermentação ocorre com:
Dadas as equações químicas balanceadas:
Fe(s) ➜ Fe2+(aq) + 2e- (oxidação)
O2(g) + 2H2O(l) + 4e- ➜ 4OH- (redução)
A equação química balanceada que descreve a oxidação do ferro em meio aquoso neutro será:
Considere a equação química (não balanceada) para a combustão do etanol:
C2H6O(l) + O2(g) ➜ CO2(g) + H2O(l)
Dados: Entalpia de formação de C2H6O(l) = – 66 kcal/mol
Entalpia de formação de CO2(g) = – 94 kcal/mol
Entalpia de formação de H2O(l) = – 68 kcal/mol
A entalpia de combustão em kcal/mol será:
Tal afirmação é referente a:
Leia o texto e analise a tabela sobre entalpias de ligação para responder à questão.
O lixo urbano pode ser usado para a produção de uma importante fonte de energia, o metano. Essa substância é produzida na decomposição anaeróbica da matéria orgânica, podendo ser usada como combustível em veículos e na indústria.
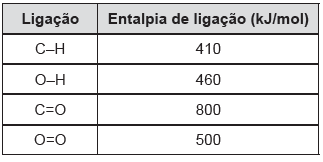
Considerando os valores aproximados das entalpias
de ligação apresentados na tabela, em relação ao
metano é possível afirmar que
A produção de muitos dos alimentos e bebidas mais apreciados envolve processos fermentativos. A produção do vinho e da cerveja, realizada com auxílio do Saccharomyces cerevisiae, é um exemplo. Esse micro-organismo é capaz de alimentar-se de açúcares simples, como a glicose, produzindo etanol e dióxido de carbono, como mostra a equação química não balanceada a seguir.
C6 H12O6 → CH3 CH2 OH + CO2
Sobre esse assunto, é correto afirmar que
O benzeno reage completamente com oxigênio, conforme indicado na equação:
2 C6 H6 (l) + 15 O2 (g) → 12 CO2 (g) + 6 H2O (g); ∆H° = -6.600 kJ
Um volume, em mL, de benzeno foi reagido em excesso de oxigênio produzindo -132 kJ de energia. Se a densidade do benzeno é 0,88 g mL-1 , o volume do hidrocarboneto mais próximo daquele que reagiu foi
Dado
M (C6
H6
) = 78,0 g mol-1
• Dada a reação química balanceada, identifique a espécie que sofre redução, a espécie que sofre oxidação, o agente redutor e o agente oxidante e assinale a alternativa que apresenta a associação correta.
3 Cu(s) + 8HNO3(aq) → 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(I)
Dados:

Considere as afirmações abaixo, sobre os dados da tabela.
I - O lítio metálico é um forte agente redutor. II - O cátion prata pode oxidar o cobre metálico para Cu2+ . III- O zinco é o ânodo em uma pilha com eletrodos de zinco e chumbo.
Quais estão corretas?
I - A vaporização do etanol é um processo exotérmico.
II - Os produtos de uma reação de combustão têm entalpia inferior aos reagentes.
III- A reação química da cal viva (óxido de cálcio) com a água é um processo em que ocorre absorção de calor.
Quais estão corretas?
