Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
I - A vaporização do etanol é um processo exotérmico.
II - Os produtos de uma reação de combustão têm entalpia inferior aos reagentes.
III- A reação química da cal viva (óxido de cálcio) com a água é um processo em que ocorre absorção de calor.
Quais estão corretas?
LIMA, M. E. C. C.; DAVID, M. A.; MAGALHÃES, W. F de. Ensinar Ciências por investigação: um desafio para os formadores. Química Nova na Escola, n. 29, ago. 2009. p. 25. Adaptado.
De acordo com o texto, marque a alternativa que apresenta uma informação INCORRETA sobre o que ocorre na bolsa térmica.
No gráfico a seguir, é apresentada a variação da energia durante uma reação química hipotética.
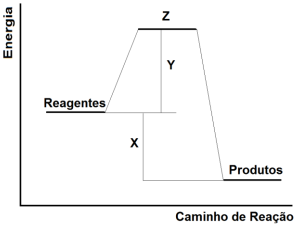
Com base no gráfico, pode-se correlacionar X, Y e Z, respectivamente, como
Um palito de fósforo queima transformando trissulfeto de tetrafósforo em pentóxido de difósforo e dióxido de enxofre, de acordo com a reação termoquímica a seguir.
P4 S3(s) + 8 O2(g) → 2 P2 O5(s) + 3 SO2(g); ΔH° = -3680 kJ mol-1
Um palito de fósforo contém 200 mg de P4 S3 , logo a sua combustão libera energia, cujo valor em joules é mais próximo de
Dados
MP = 31 g mol-1
MS = 32 g mol L-1
Quando o ferro ou o aço, já com camada de Fe2O3 , sofre corrosão em presença de umidade, têm-se as reações abaixo, em que Fe3O4 é de fato FeO·Fe2O3
Reação I: Fe → Fe2++ 2e
Reação II: 4 Fe2O3 + Fe2++ 2e → 3 Fe3O4
Nesse processo corrosivo,
Na Figura abaixo, é mostrada a reação de adição do bromo (Br2 ) ao estireno.
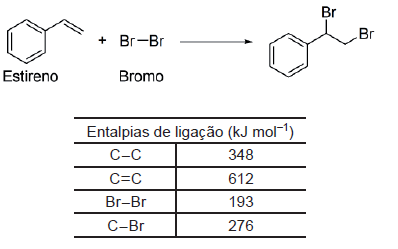
Considerando os valores de entalpia de ligação da Tabela,
o valor da entalpia de reação, em kJ mol-1
, será:
A transferência do alumínio da panela para o alimento envolve a:
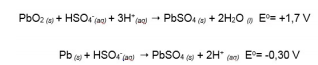
Analise as alternativas abaixo selecionadas com as semi-reações (1) e (2). I. Na Equação 1, é onde ocorre a reação de oxidação, e na Equação 2 a reação de redução. II. A Equação 1 pode ser identificada como anodo e a Equação 2 o catodo. III. No processo eletroquímico, estão envolvidos 2 mols de elétrons. IV. O chumbo é agente redutor e, também, agente oxidante. V. A célula voltaica gera 2 Volts.
Está incorreto o que se afirma em
A partir do exposto, conclui-se que a propriedade da radiação alfa que garante a segurança da utilização de detectores de fumaça contendo o amerício-241 é:
CaO(s) + H2O(l) → Ca(OH)2 + 63,7 kJ
afirma-se que temos uma reação
CaCO3(s)
 CaO(s) + CO2(g)
CaO(s) + CO2(g)
Que volume de CO2 será obtido, considerando o rendimento reacional de 80%?

Ao se misturar 100 mL de HCl 1/mol/L com100 mL de NaOH de mesma concentração,obtém-se uma solução de NaCl (sal de cozinha) e observa-se claramente um aumento de temperatura.
Diante do exposto, pode-se afirmar que se trata de uma reação
A figura a seguir, ilustra um esquema do processo eletroquímico que ocorre nas baterias de íons de lítio.

Sobre tais reações, pode-se dizer que:
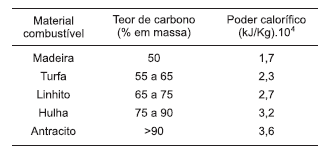
O carvão mineral é o mais abundante combustível fóssil existente na natureza. Ele é utilizado como fonte de energia desde a antiguidade e sua comercialização vem desde o Império Romano. A origem desse mineral remonta há cerca de 300 milhões de anos, no período Carbonífero, quando grande quantidade de biomassa, coberta por águas estagnadas, foi transformada em turfa, e, em seguida, em carvão. A hulha é um dos materiais carboníferos de grande importância econômica porque é uma fonte de hidrocarbonetos aromáticos, de gases combustíveis e de coque, resíduo utilizado em siderúrgicas. No Brasil, em Charqueadas, município do Rio Grande do Sul, encontra-se uma das minas de subsolo do Estado com 90% das reservas de carvão mineral do país.
A partir das informações do texto, da tabela que representa o teor de carbono de algumas espécies carboníferas e dos dados da tabela, é correto afirmar:
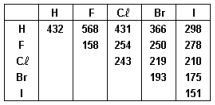
O cloreto de hidrogênio é um gás que, quando borbulhado em água, resulta numa solução de ácido clorídrico. Esse composto é um dos ácidos mais utilizados nas indústrias e laboratórios químicos. A energia para formação de 2 mol de cloreto de hidrogênio, em kJ, a partir de seus elementos é igual a:
