Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
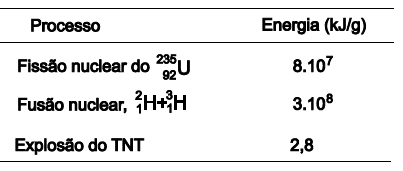
A energia liberada na reação de fusão de 1,0g de urânio 235 é muito maior que a produzida na explosão de 1,0g de TNT. Essa energia, quando controlada em um reator nuclear, pode ser utilizada nas usinas termonucleraes, na geração de energia elétrica, por meio da produção de vapor de água, que movimenta a turbina de um gerador elétrico. Embora a quantidade de energia liberada na fusão nuclear seja muito maior que a da fissão do urânio 235, e mais vantajosa para geração de energia elétrica, não foi ainda desenvolvida uma tecnologia adequada ao seu aproveitamento. A partir dessas considerações e dos dados apresentados na tabela, é correto afirmar:
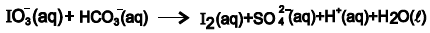
O iodato de sódio, NaIO3 , é utilizado como aditivo de sal de cozinha, NaCl, com objetivo de prevenir o bócio, uma doença provocada pela deficiência de iodo na alimentação. A equação química não balanceada representa a reação do íon iodato com o íon hidrogeno-sulfito, na determinação de iodo, I2 .
A partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
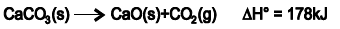
O calcário formado principalmente por carbonato de cálcio, CaCO3 (s), é um mineral importante na correção da acidez do solo, na produção de cimento e de óxido de cálcio CaO, conhecido como cal.
O Brasil utiliza cerca de um milhão de toneladas de óxido de cálcio por ano. A partir da decomposição térmica do carbonato de cálcio representada pela equação química, é correto afirmar:
Com base nesta informação, podemos afirmar que as substâncias adicionais promoverão:

II) A etapa 2 de separação dos gases ocorre por liquefação seguida de destilação fracionada.
III) O processo Haber-Bosch consiste em uma reação de síntese total.
IV)Asoma dos coeficientes mínimos e inteiros da equação na etapa 4 é 19.
V) A etapa 4 é uma reação catalítica de oxirredução.
A sequência correta que corresponde, respectivamente, à questão é
Eº (Al3+/Al) = –1,66 V Eº (Sn2+/Sn) = –0,14 V
Escolha a alternativa correspondente às associações corretas:

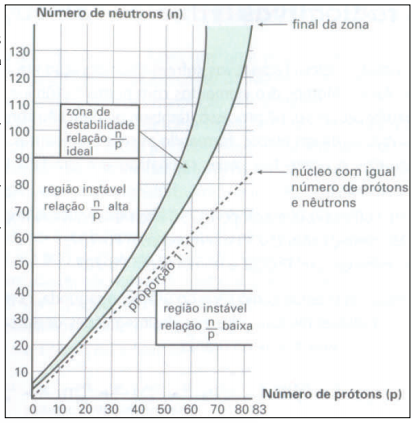
Dentre os 330 isótopos naturais, cerca de 270 são estáveis, os outros se desintegram espontaneamente. É a radioatividade natural. A relação (A – Z) / Z permite determinar se o isótopo de um elemento apresentará radioatividade natural. Isto ocorre quando esta relação é superior ou igual a 1,5. A figura abaixo relaciona o número de prótons e o número de nêutrons para os núcleos dos átomos dos elementos que, em função da relação n/p, permitem prever o tipo de desintegração sofrido por este elemento, caso este elemento apresentar radioatividade natural. A partir da análise da figura e considerando 5 isótopos hipotéticos chamados E1, E2, E3, E4 e E5, seria possível afirmar que:

As células cancerígenas podem ser destruídas quando expostas à radiação. O cobalto 60 é um radioisótopo aplicado em tratamento de radioterapia. A equação abaixo mostra o decaimento radioativo.
6027Co → X + 6028Ni
Pode-se afirmar que a radiação representada por X é
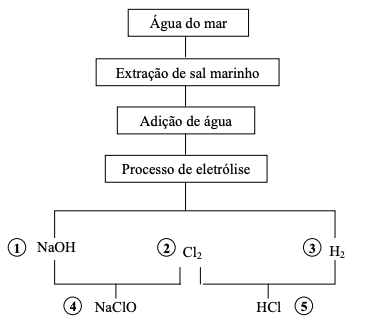
A partir dessas informações, analise as afirmativas.
I - O subproduto 1 da eletrólise é o hidróxido de sódio, conhecido como soda cáustica, matéria-prima utilizada na fabricação de sabão, detergentes e papel. II - Para obtenção de 36,5 g do subproduto 5 são necessários 0,5 mol de H2 e 0,5 mol de Cl2. III - A eletrólise ocorrida entre o sal marinho e a água é uma reação espontânea, sem necessidade de energia para a sua realização. IV - O subproduto 4 é utilizado para lavagem de roupas coloridas. V - O subproduto 3 é extremamente reativo e perigoso, utilizado na produção de amônia.
Estão corretas as afirmativas
KMnO4 (aq) +HF (aq) → KF (aq) + MnF2 (aq) + H2O (l) + F2 (g)
Balanceie a equação química e, baseando-se na equação balanceada, assinale a proposição correta acerca dos estados de oxidação das espécies químicas e da estequiometria da reação:
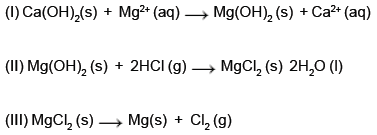
A partir das reações representadas e das propriedades dos elementos e substâncias, é correto afirmar:
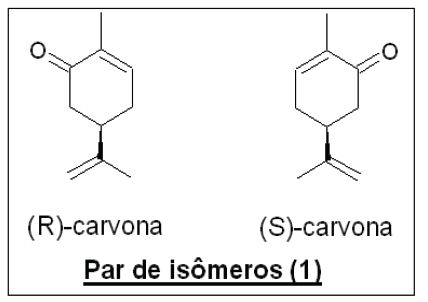
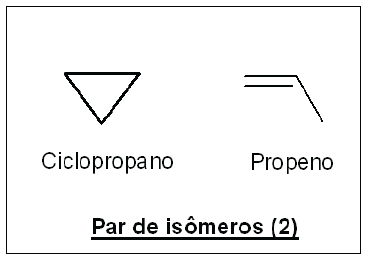
Acerca das propriedades e da relação de isomeria entre os compostos, é correto afirmar:
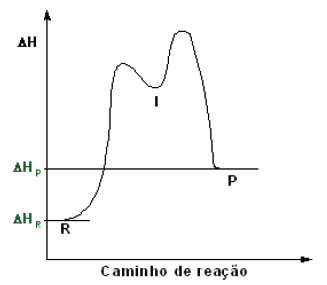
Admitindo que R corresponde aos reagentes, I ao intermediário e P aos produtos, é correto afirmar que
Considerando essa informação, pode-se concluir:
 Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V  Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V 