Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
Os combustíveis usuais são misturas de hidrocarbonetos que variam com a origem geográfica do petróleo utilizado e dos processos de refino aplicados. De fato, a mistura só pode ser comercializada se ela verifica características estritas sobre as propriedades físicas (densidade, volatilidade), energéticas (poder calórico) e químicas (índice de octanagem, limitação dos teores em certos componentes). Para determinar as propriedades energéticas dos combustíveis, um hidrocarboneto padrão serve como modelo. Para a gasolina, a referência é o octano C8H18.
Em um motor, é a reação de combustão da gasolina que fornece a energia necessária ao seu funcionamento. A energia liberada é proveniente do rearranjo das ligações químicas, conforme mostra a figura abaixo. O ciclo termodinâmico abaixo permite encontrar o valor de ΔrHo .
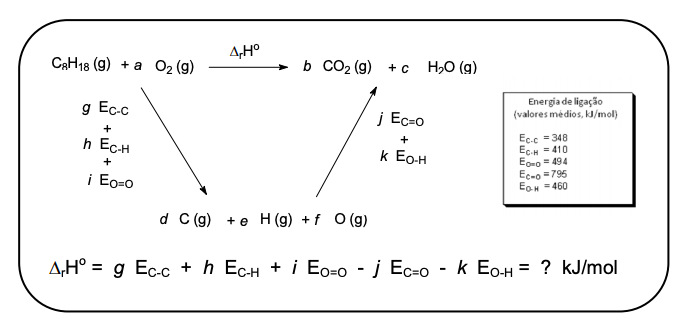
Considerando o ciclo termodinâmico acima e após o balanceamento das reações, indique com V as alternativas corretas e com F as alternativas falsas.
( ) A energia de combustão do octano é de –5.009,0 kJ/mol.
( ) A energia necessária para formar todas as ligações do gás carbônico produzido durante a reação de combustão do octano é de –6.360,0 kJ/mol.
( ) A energia necessária para formar todas as ligações da água produzida durante a reação de combustão do octano é de –4.140,0 kJ/mol.
( ) A energia necessária para quebrar todas as ligações do octano é de +10.164,0 kJ/mol.
( ) A energia necessária para a quebra de todas as ligações dos reagentes consumidos durante a reação de combustão do octano é +16.339,0 kJ/mol.
Assinale a alternativa que indique a sequência exata:

Habitantes de uma região do Cerrado deixaram de utilizar GLP para a produção de energia de uso doméstico e passaram a produzir e a usar o biogás, combustível rico em metano, obtido a partir da fermentação anaeróbica de restos de biomassa e de dejetos de bovinos e de suínos. A preferência pelo biogás em lugar do gás liquefeito de petróleo, GLP, que contém propano e butano, se deu por razões de economia de energia.
Considerando-se essas informações, é correto afirmar:
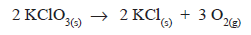
O isótopo radioativo  , que possui meia-vida de
oito dias, é utilizado no diagnóstico e no tratamento de
problemas da tireoide. Se 10 mg de iodo-131 recémproduzido foi administrado a um paciente, quantos
miligramas estarão ainda presentes no seu organismo
após 32 dias?
, que possui meia-vida de
oito dias, é utilizado no diagnóstico e no tratamento de
problemas da tireoide. Se 10 mg de iodo-131 recémproduzido foi administrado a um paciente, quantos
miligramas estarão ainda presentes no seu organismo
após 32 dias?
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
A reação 2B2O3(S) + 2H2O(l) ==> 4HBO2(aq) é endotérmica.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
A formação de 352 g de HBO2, a partir de H2B4O7 e água, produz um ∆H de -29,0 kJ.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
O ∆H para a reação 2H2B4O7(aq) + 10H2O(l) ==> 8H3BO3(aq) é igual a -10,6 kJ.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
A Lei de Hess diz que a variação de entalpia em uma reação depende apenas do estado final da reação.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
O ∆H para a reação 2H3BO3(aq) ==> B2O3(s) + 3H2O(l) é igual a 14,0 kJ.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
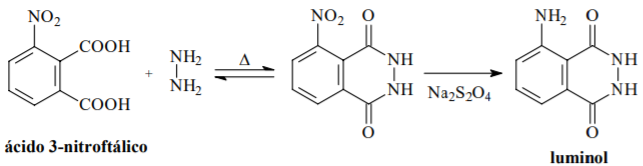
O Na2S2O4 atua como agente oxidante.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Uma pilha montada com cobre e prata possui equação global 2Ag+ + Cu ==> 2Ag + Cu2+.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Uma pilha montada nas condições padrão com os pares Zn2+/Zn e Cu2+/Cu terá o eletrodo de cobre metálico como polo negativo da pilha.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao mergulharmos um fio de cobre metálico em uma solução 1,0 mol/ℓ de íons Zn2+ a 25 °C e 1,0 atm, ocorrerá deposição espontânea de zinco sobre o fio de cobre.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ao mergulharmos um fio de cobre metálico em uma solução de íons Ag+, nas condições padrão, ocorrerá deposição espontânea de prata sobre o fio de cobre.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Uma pilha montada nas condições padrão com os pares Zn2+/Zn e Ag+/Ag fornecerá uma f.e.m. de 2,36 V.
I. A reação que ocorre pelo caminho A é mais lenta, sem catalisador e com energia de ativação (Ea ) maior. II. A reação que ocorre pelo caminho B é mais rápida, com catalisador, sendo as energias de ativação das duas etapas (Ea1 e Ea2) menores. III.As reações que ocorrem pelo caminho A e B possuem a variação de entalpia (ΔH) > 0, portanto são endotérmicas. IV.As reações que ocorrem pelo caminho A e B possuem a variação de entalpia ( ΔH) < 0, portanto são exotérmicas. V. As reações que ocorrem pelo caminho A e B possuem velocidades iguais, pois o produto final tem a mesma energia.
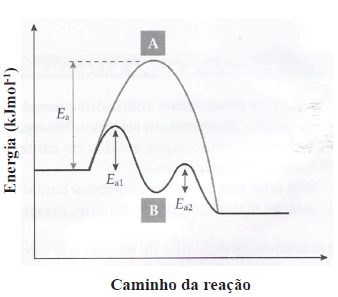
Marque a opção correta