Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões

A nova Tabela Periódica, atualizada em março de 2017 pela
IUPAC, contém os nomes e símbolos dos elementos químicos
niônio113, moscóvio115, tennessínio117 e oganessônio118,
em homenagem aos pesquisadores e descobridores
japoneses, russos e americanos. Os novos elementos são
transactinoides de existência efêmera, de frações de segundos
e foram sintetizados nos aceleradores de partículas. Assim,
completam o sétimo período da Tabela. A equipe de
pesquisadores do niônio113, vai em busca do 119 e de suas
propriedades, o primeiro elemento químico do oitavo período.
As propriedades periódicas dos elementos químicos,
organizados em grupos e períodos, estão relacionadas aos
números atômicos e configurações eletrônicas. As tendências
dessas propriedades são verificadas em um grupo ou de um
grupo para o outro, ou entre elementos de um período.
Todos os gases na condição de baixa massa específica obedecem à lei dos gases ideais.
Considerando-se a constante dos gases ideais igual a 8,3J/mol.K, é correto afirmar:
I. Decomposição do mármore: CaCO3(s) →CaO(s) + CO2(g)
II. Produção do gás hidrogênio a partir do metano: CH4(g) + H2O(v) → CO(g) + 3H2(g)
III. Oxidação da sacarose: C12H22O11(s) + 12 O2(g) → 12 CO2(g) + 11 H2O(l)
Dados:
Tabela – Entalpia padrão de formação de algumas substâncias a 25 ºC e 1 atm.
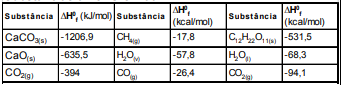
Calcule, a partir dos dados acima, a variação de entalpia das reações e assinale a opção correta:
Os efeitos globais gerados pela poluição advinda da queima de combustíveis fósseis tem levado à urgente necessidade por fontes alternativas de energia. Nesse contexto, o etanol (C2 H6O) e o gás hidrogênio (H2) emergem como possíveis substitutos da gasolina (C8 H18). A seguir estão apresentadas as reações de combustão de cada uma dessas espécies e os respectivos valores de entalpia padrão (25 ºC):
(Dadas as massas molares em g/mol: H=1, C=12, O=16)
C8
H18 + 12,5 O2 -> 8 CO2
+ 9 H2O
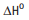 = –5471 kJ/mol
= –5471 kJ/mol C2
H6O + 3 O2 -> 2 CO2
+ 3 H2O
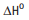 = –1368 kJ/mol
= –1368 kJ/mol H2
+ ½ O2 -> H2O
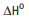 = –286 kJ/mol Com base nessas informações, pode-se afirmar que:
= –286 kJ/mol Com base nessas informações, pode-se afirmar que: O livro “As Garotas da Cidade Atômica” (Denise Kiernan), lançado em 2015, aborda a presença de mulheres anônimas, que passaram despercebidas pela história, recrutadas em todos os Estados Unidos para trabalharem na cidade secreta de Oak Ridge em troca de bons salários. A cidade era sede do Projeto Manhattan, codinome de um plano criado para enriquecer urânio e criar bombas para uso bélico.
Eram secundaristas, químicas, estatísticas e secretárias, que pouco ou nada sabiam sobre o real propósito do que faziam e do misterioso projeto. A finalidade só foi divulgada ao mundo após o lançamento das bombas atômicas sobre Hiroshima e Nagasaki, no Japão, em agosto de 1945.
Uma das possíveis reações de fissão nuclear, que ocorre na explosão da bomba atômica está representada a seguir:
92U235 + 0 n1 → 56 Ba141 + 36Kr 92 + 3 X + energia
Na equação apresentada, X representa a:
 Fonte da figura: http://www.foz.unioeste.br/~lamat/downmateriais/materiaiscap9.pdf
adaptada).
Fonte da figura: http://www.foz.unioeste.br/~lamat/downmateriais/materiaiscap9.pdf
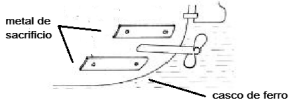
adaptada). Considerando a equação de redução do ferro: Fe+2 + 2e- → Fe° Eº = - 0,44 V Assinale a alternativa que apresenta um metal de sacrifício que poderia ser usado nas plaquetas fixadas ao casco do navio, de forma a proteger o ferro da oxidação.
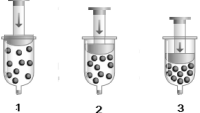
(Fonte Figura: Santos e Mól – Quimica Cidadã- 1ª série Editora AJS-SP(2011)).
Admitindo que o experimento tenha sido realizado em temperatura constante, pode-se afirmar que o gráfico que representa a transformação gasosa acima é:

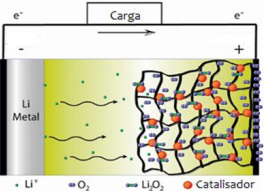 Disponível em: http://sciencewatch.com/ Adaptado
Disponível em: http://sciencewatch.com/ Adaptado Geradores desse tipo
Analise o fenômeno representado ao lado.
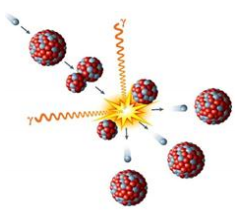
Fonte: Ilustração: Peter Hermes Furian / Shutterstock.com
Uma aplicação desse fenômeno é verificada na
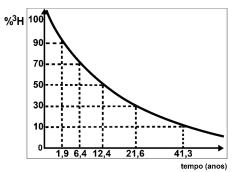 Disponível em: http://qa.ff.up.pt/radioquimica/rq-tp/rq-tp03.pdf. Adaptado
Disponível em: http://qa.ff.up.pt/radioquimica/rq-tp/rq-tp03.pdf. Adaptado Quantos anos possui uma amostra de água retirada de um lençol freático cuja concentração de hélio-3 é nove vezes superior à quantidade de trítio?
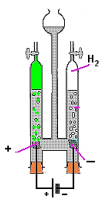
Fonte: http://www.docbrown.info/page01/ExIndChem/electrochemistry03.htm. Adaptado
A substância produzida no ânodo é um
Na Medicina Nuclear, existem duas modalidades: o diagnóstico e o tratamento. Nas doenças da tireoide, por exemplo, uma das formas de diagnóstico por imagem é por meio do exame de cintilografia. O exame usa iodo-123, que é emissor de raios gama e possui meia vida de 13 horas, visto que o radioisótopo mapeia a tireoide ao se acumular em seu tecido. Já para o tratamento, é utilizado o iodo-131, que emite raios beta e possui meia vida de 8 dias, uma vez que a radiação emitida por ele destrói as células doentes.
Dado: 53I123 53I131
Sobre o iodo e as informações citadas, assinale a afirmação CORRETA.
Dados:
Massa atômica: C = 12 O = 16 Cgrafite + O2(g) → CO2(g) ΔH= - 393,5 kJ/mol Cdiamante + O2(g) → CO2(g) ΔH= - 395,4 kJ/mol
I. Alumínio II. Ferro III. Níquel IV. Cobre V. Prata
Assinale a alternativa que apresenta somente materiais em que a solução pode ser armazenada sem ocorrência de reação com o recipiente:
Dados:
Al3+(aq) + 2e- → Al(s) E°=-1,66 V Fe2+(aq) + 2e- → Fe(s) E°=-0,44 V Ni2+(aq) + 2e- → Ni(s) E°=-0,25 V Co2+(aq) + 2e- → Co(s) E°=-0,28 V Cu2+(aq) + 2e- → Cu(s) E°=+0,34 V Ag+(aq) + 2e- → Ag(s) E°=+0,80 V

I. (CH2O)n + O2 → CO2 + H2O + Energia II. H2O + CO2 + hν → (CH2O)n + O2
Sobre os processos, é CORRETO afirmar:
I. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔHo= −212,8kcalmol−1 II. CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
( ) A partir dos métodos do calor de formação e da energia de ligação, obtêm-se os mesmos valores de variação de entalpia da reação expressa na equação química I. ( ) A queima de alcanos só é exotérmica se os produtos forem gasosos. ( ) A reação expressa na equação química II é mais exotérmica que aquela expressa na equação química I. ( ) O calor da reação expressa na equação química II equivale à soma do calor de vaporização da água com o calor envolvido na reação expressa na equação química I.
A alternativa que contém a sequência correta, de cima para baixo, é a

Quem tem medo da radioatividade?
Como herança da destruição causada pela explosão das bombas atômicas ao fim da Segunda Guerra, a energia nuclear ganhou uma reputação difícil de mudar. Um novo livro desmistifica a radioatividade e aponta as vantagens e desvantagens de seu uso. Foram mais de cem mil mortos imediatamente após a explosão das bombas nucleares em Hiroshima e Nagasaki, em agosto de 1945. Ironicamente, as mesmas propriedades do átomo capazes de causar tamanha destruição também podiam salvar vidas se empregadas no tratamento de câncer. A radioterapia, o exame de raios-X e o marca-passo artificial são exemplos de aplicações pacíficas da radioatividade. Para muitos, no entanto, a função da energia nuclear se resume a dizimar vidas. O temor suscitado pelos cogumelos atômicos se espalhou pelo mundo e ecoa até hoje devido à falta de informações precisas sobre o tema.
O risco de acidentes e a destinação do lixo nuclear
são tratados de forma esclarecedora, ao se
destacarem as aplicações da tecnologia nuclear
na medicina molecular, na agricultura, na
indústria e na datação de artefatos na
arqueologia, e tudo que envolve a geração de
energia nas usinas nucleares, como alternativa à
queima de combustíveis fósseis das usinas
termelétricas de gás e carvão e ao impacto
socioambiental das hidrelétricas. Os fantasmas
associados às usinas nucleares – o risco de
acidentes e a destinação do lixo nuclear – são
tratados de forma esclarecedora pelos
pesquisadores sobre a radioatividade. (VENTURA,
2017);

Quem tem medo da radioatividade?
Como herança da destruição causada pela explosão das bombas atômicas ao fim da Segunda Guerra, a energia nuclear ganhou uma reputação difícil de mudar. Um novo livro desmistifica a radioatividade e aponta as vantagens e desvantagens de seu uso. Foram mais de cem mil mortos imediatamente após a explosão das bombas nucleares em Hiroshima e Nagasaki, em agosto de 1945. Ironicamente, as mesmas propriedades do átomo capazes de causar tamanha destruição também podiam salvar vidas se empregadas no tratamento de câncer. A radioterapia, o exame de raios-X e o marca-passo artificial são exemplos de aplicações pacíficas da radioatividade. Para muitos, no entanto, a função da energia nuclear se resume a dizimar vidas. O temor suscitado pelos cogumelos atômicos se espalhou pelo mundo e ecoa até hoje devido à falta de informações precisas sobre o tema.
O risco de acidentes e a destinação do lixo nuclear
são tratados de forma esclarecedora, ao se
destacarem as aplicações da tecnologia nuclear
na medicina molecular, na agricultura, na
indústria e na datação de artefatos na
arqueologia, e tudo que envolve a geração de
energia nas usinas nucleares, como alternativa à
queima de combustíveis fósseis das usinas
termelétricas de gás e carvão e ao impacto
socioambiental das hidrelétricas. Os fantasmas
associados às usinas nucleares – o risco de
acidentes e a destinação do lixo nuclear – são
tratados de forma esclarecedora pelos
pesquisadores sobre a radioatividade. (VENTURA,
2017);
2 H2O + 2 e- → H2 + 2 OH- E° = - 0,828 V ½ O2 + H2O + 2 e- → OH- E° = + 0,401 V
Levando-se em conta essas informações e as assertivas a seguir,
I. A reação global da pilha de combustível é H2 + ½ O2 → H2O II. O hidrogênio sofre oxidação no processo. III. A diferença de potencial da pilha de combustível, em condição padrão, é igual a 1,229 V. IV. O gás oxigênio (O2) é o agente redutor.
Pode-se afirmar que estão CORRETAS apenas: