Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
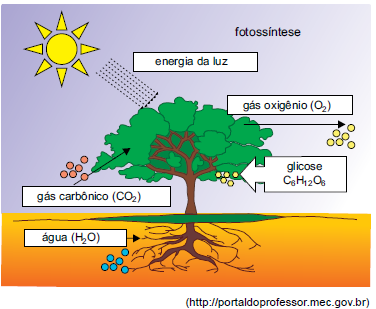
É correto afirmar que a fotossíntese é uma reação
Considere a tabela para responder à questão

(http://qnint.sbq.org.br. Adaptado.)
Dentre as substâncias da tabela, aquela que atende às características necessárias para o uso seguro como meio de contraste em exames radiológicos é a substância
Os valores das entalpias-padrão de formação, como os apresentados na tabela, podem ser utilizados para prever a variação de entalpia associada a uma reação química, a exemplo da desidratação intramolecular do etanol, na presença do ácido sulfúrico, que leva à formação do eteno e da água, de acordo com a reação representada pela equação química
C2H6O(ℓ) → C2H4(g) + H2O(ℓ)
Considerando-se essas informações e os valores das entalpias-padrão de formação do eteno, do etanol e da água, relacionados na tabela, é correto afirmar:
O cloreto de bário, BaCl2(s), é um composto químico tóxico, de temperatura de fusão 962°C, que deve ser manipulado com cuidado porque, quando inalado, pode causar lesões no cérebro e problemas intestinais. Esse sal é utilizado na produção de gás cloro, Cl2(g), por eletrólise ígnea, de acordo com as transformações representadas, de maneira simplificada, pelas semi-equações na tabela.
Considerando-se essas informações e os conhecimentos sobre eletroquímica, é correto afirmar:
Considerando-se as informações do texto associadas aos conhecimentos sobre soluções aquosas, é correto afirmar:
SILVEIRA, Evanildo da. O ouro do século XXI. Planeta. São Paulo: Três, a. 45, e. 533, ago. 2017, p. 36-39. Adaptado.
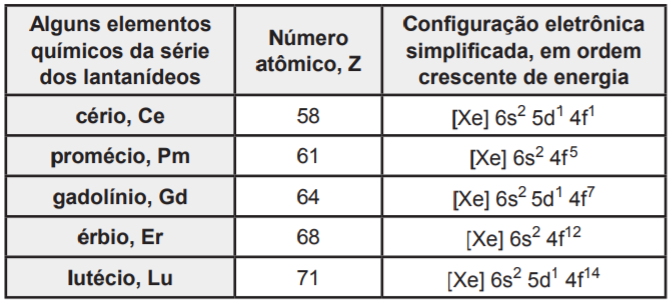
Considerando-se as informações e as propriedades dos elementos químicos, é correto afirmar:
C6(s) + Li+ (PC) + e- → LiC6(s) E° = 0,855 V
CoO2(s) + Li+ (PC) + e- → LiCoO2(s) E° = - 2,745 V
Baseado nos dados acima, qual a equação global e o potencial da pilha?
2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H6O(l) ΔHf = ?
Energeticamente, a entalpia padrão de formação do etanol pode ser determinada através de 3 diferentes equações de combustão. As equações estão representadas abaixo:
C(graf) + O2(g) → CO2(g) ΔHf = -394 kJ mol-1
H2(g) + 1/2 O2(g) → H2O(l) ΔHf = -286 kJ mol-1
C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l) ΔHf = -1368 kJ mol-1
Baseado nos dados acima, qual o ΔHf do etanol, em kJ.mol-1?
Al2O3(s) + 3 C(s) → 2 Al(l) + 3 CO(g)
O processo de extração demanda um custo energético de aproximadamente 600 kJ para a obtenção de 54 g de alumínio, enquanto para a mesma massa através da reciclagem são utilizados 50 kJ de energia. Quanto é economizado de energia, para cada 108 kg do alumínio reciclado em relação ao material extraído da bauxita, em 106 kJ?
Dados: Massas atômica em g·mol-1 : Al = 27.
A pilha seca foi inventada e patenteada em 1866 pelo engenheiro francês Georges Leclanché. A pilha de Leclanché é a precursora das pilhas secas modernas, podendo ser utilizadas em lanternas, rádios portáteis, gravadores, brinquedos etc. As reações que ocorrem na pilha seca são as seguintes:
No cátodo:
2 MnO2(s)+2 NH4 + (aq)+2 e−→ Mn2O3(s)+2 NH3 (aq)+ H2O(l) E° = 0,737 V
No ânodo:
Zn → Zn2+ + 2 e− E° = − 0,763 V
Qual é a máxima variação de potencial (ΔE) obtida nesta pilha?
C6H12O6(s) + 6 O2(g) → 6 CO2(g) + 6 H2O(l) + calor
Quando 1 mol de glicose reage, quantos mols de elétrons são transferidos nesta reação redox?
Hb(aq) + CO(aq)
 HbCO(aq) ΔG° = −80 kJ.mol -1 Hb(aq) + O2(aq)
HbCO(aq) ΔG° = −80 kJ.mol -1 Hb(aq) + O2(aq) HbO2(aq) ΔG° = −70 kJ.mol -1
HbO2(aq) ΔG° = −70 kJ.mol -1 De acordo com as equações químicas acima, qual é a variação de energia livre para a reação de substituição do CO ligado à hemoglobina (HbCO) pelo O2?
Sabendo que a reação de combustão da glicina é representada pela equação química:
4 C2H5NO2(s) + 9 O2(g) → 8 CO2(g) + 10 H2O(g) + 2 N2(g)
calcule o calor liberado na reação acima, a 298 K, a partir das entalpias-padrão de formação listadas na Tabela 1.
Tabela 1. Entalpias-padrão de formação, ∆Hf°, a 298 K.
Substância C2H5NO2(s) CO2(g) H2O(l)
∆Hf°(kJ/mol) −533,0 −394 −286
Dados: Massa molar do metano = 16 g.mol-1 .Calor de combustão do metano , △H° = 210 kcal.mol-1 .
Calor específico da água = 1,0 cal.g-1 .°C-1 .
De acordo com os potenciais de redução descritos abaixo, em qual(is) recipiente(s) será possível armazenar a solução de CuSO4, sem que ocorram reações químicas redox espontâneas?
Zn2+(aq) + 2e- → Zn(s) - 0,76 V Fe2+(aq) + 2e- → Fe(s) - 0,44 V Ni2+(aq) + 2e- → Ni(s) - 0,25 V Cu2+(aq) + 2e- → Cu(s) + 0,34 V Ag+ (aq) + e- → Ag(s) + 0,80 V
CH3CH2OH + OH· → H2O + CH3CHOH·
Sobre esta reação, podemos afirmar o que segue.
8 Cl2(g) + 8 H2S(aq) → S8(s) + 16 HCl(aq)
Analisando a reação redox acima, três afirmações foram feitas:
1) O H2S é o agente oxidante.
2) O NOX (número de oxidação) do cloro varia de zero para -1; portanto, o cloro sofre redução.
3) Cada mol de Cl2 gasoso recebe 2 mol de elétrons.
Está(ão) correta(s) a(s) afirmativa(s):