Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 963 questões
Uma pilha de Daniel é um dispositivo capaz de transformar energia química em energia elétrica, e como exemplo
tem-se uma formada por eletrodos de ferro 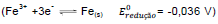 e estanho
e estanho 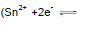
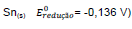 . Nesse caso, constata-se que
. Nesse caso, constata-se que
Questão 38 As chalconas são uma classe de moléculas que possuem vários tipos de atividades farmacológicas. No processo de cristalização de um dos derivados de chalcona, mediu-se uma variação da energia livre de Gibbs e da entalpia a 27 °C de -64 kcal.mol-1 e -164 kcal.mol-1 , respectivamente.
Nesse caso, a temperatura, em Kelvin, a partir da qual a cristalização sofrerá uma transição de um processo espontâneo para não-espontâneo, será de aproximadamente
No dia 11 de fevereiro, comemora-se o Dia Internacional das Mulheres e Meninas na
Ciência, data estabelecida pela Assembleia Geral da ONU em reconhecimento ao trabalho feminino
para o desenvolvimento científico. Dentre tantas mulheres que contribuíram para a ciência no século
XX, a física nuclear austríaca Lise Meitner (1878-1968) se destacou por suas descobertas e pela
Teoria da Fissão Nuclear, sendo, inclusive, considerada a mãe da era atômica.
 https://www.thefamouspeople.com/profiles/images/lise-meitner-3.jpg. Acesso em 02.fev.2019.
https://www.thefamouspeople.com/profiles/images/lise-meitner-3.jpg. Acesso em 02.fev.2019. A teoria que deu o título de mãe da era atômica à Lise Meitner consiste no

Quando se balancear uma reação química, deve-se obedecer à lei da conservação da massa. Ao se balancear reações de oxirredução, existe uma exigência adicional: os elétrons recebidos e doados devem estar balanceados.
Desta forma, é correto afirmar que a reação de oxirredução entre o íon permanganato e o íon oxalato em solução aquosa ácida, representada abaixo, estará balanceada quando os coeficientes estequiométricos forem, respectivamente:
MnO4- (aq) + C2O42- (aq) + H+ (aq) Mn2+ (aq) + H2O (l) + CO2 (g)
Mn2+ (aq) + H2O (l) + CO2 (g)

A Termoquímica é a área da química que estuda as reações químicas e os fenômenos físicos em que ocorrem absorção ou liberação de energia na forma de calor.
Assim, é incorreto afirmar que a entalpia de uma reação é afetada pelo(a):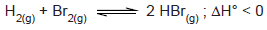
A tabela a seguir tem duas colunas, uma que indica um tipo de perturbação do equilíbrio e outra que indica a situação final do equilíbrio restabelecido.

A associação CORRETA de perturbação e situação final do equilíbrio restabelecido é indicada na alternativa
Instrução: Leia atentamente o texto abaixo para responder a questão.


A entalpia de combustão do carbono, a 25 °C, é de 393,5 kJ.mol−1. Considerando 1,0 kg de turfa, um tipo de carvão mineral que contém somente 60% de carbono, em média, a energia liberada, em kJ, somente pela queima de carbono é de, aproximadamente,
Dado:
massa molar do C = 12 g.mol−1
Algumas categorias de câncer de tireoide podem ser tratadas por meio de um tipo de radioterapia em que o radioisótopo é disponibilizado no interior do organismo do paciente. Dessa forma, a radiação é emitida diretamente no órgão a ser tratado e os efeitos colaterais são diminuídos. O radioisótopo usado nesse tipo de radioterapia decai de acordo com a equação.
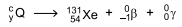
O radioisótopo 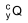 é inserido em cápsulas. Para realizar a
radioterapia, o paciente é isolado em instalação hospitalar
adequada onde ingere uma dessas cápsulas e permanece
internado até que a atividade do radioisótopo atinja valores
considerados seguros, o que ocorre após o tempo mínimo
correspondente a 3 meias-vidas do radioisótopo.
é inserido em cápsulas. Para realizar a
radioterapia, o paciente é isolado em instalação hospitalar
adequada onde ingere uma dessas cápsulas e permanece
internado até que a atividade do radioisótopo atinja valores
considerados seguros, o que ocorre após o tempo mínimo
correspondente a 3 meias-vidas do radioisótopo.
A figura apresenta a curva de decaimento radioativo para 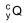 .
.
(http://www.scielo.br/pdf/abem/v51n7/a02v51n7.pdf. Adaptado)
O radioisótopo 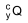 e o tempo mínimo que o paciente deve
permanecer internado e isolado quando é submetido a esse
tipo de radioterapia são, respectivamente,
e o tempo mínimo que o paciente deve
permanecer internado e isolado quando é submetido a esse
tipo de radioterapia são, respectivamente,

Numa dada combinação para montar uma pilha eletroquímica, o valor de diferença de potencial (AE) da pilha, no instante em que se ligaram os contatos, foi de 0,69 V.
A combinação utilizada nessa pilha foi entre as semicélulas:
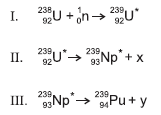
Considerando-se as informações do texto, as equações nucleares, com base na tabela periódica e nas tendências das propriedades dos elementos químicos, é correto afirmar:
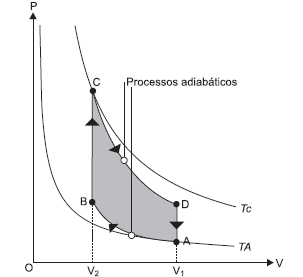
A figura representa o Ciclo de Otto, um ciclo termodinâmico que idealiza o funcionamento de motores de combustão interna de ignição por centelha.
Considerando-se os gases resultantes da combustão como gases ideais e as etapas de transformação apresentadas no diagrama pressão-volume, é correto afirmar:
( ) A densidade da gasolina permanece constante no intervalo térmico entre 25 ºC e 68,7 ºC, nas condições normais de pressão.
( ) A densidade da mistura de massas iguais de gasolina e de etanol, a 20 ºC, é, aproximadamente, 7,7.102 kg/m3 .
( ) Um carro com tanque de capacidade 60 litros pode ser abastecido com 50,0 litros de gasolina a 20 ºC e estacionado ao Sol até atingir a temperatura de 35 ºC, sem que o combustível transborde.
( ) O volume de 1,0m3 de etanol necessita de 7,44.106 J de energia para que vaporize.
A alternativa que indica a sequência correta, de cima para baixo, é a

A água, além de ser indispensável para a sobrevivência dos seres vivos, é utilizada na transformação de energia em hidrelétricas e como matéria-prima para a produção do hidrogênio, H2(g), um combustível usado em células eletrolíticas. Essas células de combustível envolve a reação entre o hidrogênio, H2(g), e o oxigênio, O2(g), com a formação de água, H2O(l), como único produto. Sob condições-padrão, as transformações químicas que ocorrem nos eletrodos da célula eletrolítica, cuja variação de potencial, ΔE°, é de + 1,23V, conforme representados na tabela.
Com base na análise das informações e nos conhecimentos
sobre Eletroquímica, é correto afirmar:
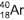 , originário do decaimento radioativo do potássio 40,
, originário do decaimento radioativo do potássio 40,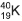 , e o xenônio tem nove, a exemplo do
xenônio 129,
, e o xenônio tem nove, a exemplo do
xenônio 129,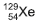 , obtido a partir do decaimento do iodo radiativo 129,
, obtido a partir do decaimento do iodo radiativo 129,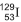 , que não existe mais nesse planeta.
(CLAUDE; STEPHEN, 2013, p. 13).
, que não existe mais nesse planeta.
(CLAUDE; STEPHEN, 2013, p. 13). Considerando-se as informações e os conhecimentos sobre estrutura atômica e radioatividade, é correto afirmar:

A nova Tabela Periódica, atualizada em março de 2017 pela
IUPAC, contém os nomes e símbolos dos elementos químicos
niônio113, moscóvio115, tennessínio117 e oganessônio118,
em homenagem aos pesquisadores e descobridores
japoneses, russos e americanos. Os novos elementos são
transactinoides de existência efêmera, de frações de segundos
e foram sintetizados nos aceleradores de partículas. Assim,
completam o sétimo período da Tabela. A equipe de
pesquisadores do niônio113, vai em busca do 119 e de suas
propriedades, o primeiro elemento químico do oitavo período.
As propriedades periódicas dos elementos químicos,
organizados em grupos e períodos, estão relacionadas aos
números atômicos e configurações eletrônicas. As tendências
dessas propriedades são verificadas em um grupo ou de um
grupo para o outro, ou entre elementos de um período.
Todos os gases na condição de baixa massa específica obedecem à lei dos gases ideais.
Considerando-se a constante dos gases ideais igual a 8,3J/mol.K, é correto afirmar:

