Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
1. C(s) + O2(g) ⇾ CO2(g) ΔH = - 94,1 kcal 2. H2(g) + ½ O2(g) ⇾ H2O(g) ΔH = - 68,3 kcal 3. C6H12O6(s) + 6 O2(g)⇾ 6CO2(g) + 6 H2O ΔH = - 673,0 kcal
Considerando as reações que conduzem à formação da glicose e apenas as informações acima, pode-se afirmar corretamente que o processo é
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2

A figura acima ilustra a alquilação de Friedel-Crafts, uma reação de substituição eletrolítica que ocorre entre um anel aromático e um cloreto de alquila. O AlCl3 é o catalisador mais usualmente empregado nesse tipo de reação. Conforme mostrado na reação a seguir, o AlCl3 liga-se ao cloro do cloreto de alquila e libera um carbocátion, que será o responsável pelo ataque eletrofílico ao anel aromático.

Considerando, além das informações do texto e da tabela acima, que as alquilações de Friedel-Crafts sejam de ordem um com relação ao composto aromático e de ordem um com relação ao cloreto de alquila, e que o grupo –OH seja um orientador orto/para dirigente, julgue o item subsequente.
Os valores de entalpias de formação dos compostos envolvidos na reação apresentada abaixo permitem concluir que a reação é endotérmica
C6H6(l) + CH3Cl(g) → C6H5CH3(l) + HCl(g)
A base de uma escultura é formada por uma placa de latão, uma liga metálica de zinco (Zn) e cobre (Cu). Para minimizar os problemas relacionados à corrosão provocada pela chuva ácida, a placa foi recoberta com uma fina camada de prata (Ag). O recobrimento foi realizado a partir da eletrólise de uma solução aquosa de AgCl, fixando-se a placa de latão no anodo da célula eletrolítica. A voltagem foi ajustada de forma a se obter corrente constante de 10,0 A.

Considerando as informações acima e assumindo que a constante de Faraday seja igual a 96.500 C/mol e que os únicos produtos formados nos eletrodos da célula eletrolítica sejam O2(g) e Ag(s), julgue o item seguinte.
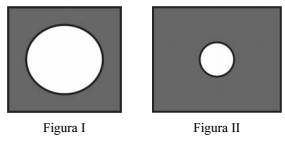
Se uma placa de latão com um furo, conforme ilustrada na figura I, for aquecida até atingir temperatura elevada, o diâmetro do furo da placa diminuirá, conforme mostrado na figura II.
A base de uma escultura é formada por uma placa de latão, uma liga metálica de zinco (Zn) e cobre (Cu). Para minimizar os problemas relacionados à corrosão provocada pela chuva ácida, a placa foi recoberta com uma fina camada de prata (Ag). O recobrimento foi realizado a partir da eletrólise de uma solução aquosa de AgCl, fixando-se a placa de latão no anodo da célula eletrolítica. A voltagem foi ajustada de forma a se obter corrente constante de 10,0 A.

Considerando as informações acima e assumindo que a constante de Faraday seja igual a 96.500 C/mol e que os únicos produtos formados nos eletrodos da célula eletrolítica sejam O2(g) e Ag(s), julgue o item seguinte.
A base de uma escultura é formada por uma placa de latão, uma liga metálica de zinco (Zn) e cobre (Cu). Para minimizar os problemas relacionados à corrosão provocada pela chuva ácida, a placa foi recoberta com uma fina camada de prata (Ag). O recobrimento foi realizado a partir da eletrólise de uma solução aquosa de AgCl, fixando-se a placa de latão no anodo da célula eletrolítica. A voltagem foi ajustada de forma a se obter corrente constante de 10,0 A.

Considerando as informações acima e assumindo que a constante de Faraday seja igual a 96.500 C/mol e que os únicos produtos formados nos eletrodos da célula eletrolítica sejam O2(g) e Ag(s), julgue o item seguinte.
Na eletrólise usada para o recobrimento, foram formados mais
mols de O2(g) que de Ag(s).
A base de uma escultura é formada por uma placa de latão, uma liga metálica de zinco (Zn) e cobre (Cu). Para minimizar os problemas relacionados à corrosão provocada pela chuva ácida, a placa foi recoberta com uma fina camada de prata (Ag). O recobrimento foi realizado a partir da eletrólise de uma solução aquosa de AgCl, fixando-se a placa de latão no anodo da célula eletrolítica. A voltagem foi ajustada de forma a se obter corrente constante de 10,0 A.

Átomos de Cu-63 e de Zn-65 têm a mesma quantidade de nêutrons.
A base de uma escultura é formada por uma placa de latão, uma liga metálica de zinco (Zn) e cobre (Cu). Para minimizar os problemas relacionados à corrosão provocada pela chuva ácida, a placa foi recoberta com uma fina camada de prata (Ag). O recobrimento foi realizado a partir da eletrólise de uma solução aquosa de AgCl, fixando-se a placa de latão no anodo da célula eletrolítica. A voltagem foi ajustada de forma a se obter corrente constante de 10,0 A.

Considerando as informações acima e assumindo que a constante de Faraday seja igual a 96.500 C/mol e que os únicos produtos formados nos eletrodos da célula eletrolítica sejam O2(g) e Ag(s), julgue o item seguinte.
Na eletrólise descrita, o tempo necessário para a deposição de
10,79 g de Ag é superior a 600 s.
A base de uma escultura é formada por uma placa de latão, uma liga metálica de zinco (Zn) e cobre (Cu). Para minimizar os problemas relacionados à corrosão provocada pela chuva ácida, a placa foi recoberta com uma fina camada de prata (Ag). O recobrimento foi realizado a partir da eletrólise de uma solução aquosa de AgCl, fixando-se a placa de latão no anodo da célula eletrolítica. A voltagem foi ajustada de forma a se obter corrente constante de 10,0 A.

Considerando as informações acima e assumindo que a constante de Faraday seja igual a 96.500 C/mol e que os únicos produtos formados nos eletrodos da célula eletrolítica sejam O2(g) e Ag(s), julgue o item seguinte.
Se, por engano, a placa de latão fosse fixada no catodo da
célula eletrolítica, então, durante a eletrólise, partículas de Zn
metálico se desprenderiam da placa, e o Cu seria oxidado a
Cu2+.


O isótopo do elemento césio de número de massa 137 sofre decaimento segundo a equação:
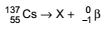
O número atômico do isótopo que X representa é igual a
Os efeitos tóxicos do dióxido de carbono exigem a sua remoção contínua de espaços fechados. A reação entre hidróxido de lítio e de dióxido de carbono é usada para remover o gás de naves espaciais e submarinos. O filtro utilizado nestes equipamentos é basicamente composto de hidróxido lítio. O ar seria direcionado para o filtro através de ventiladores, ao entrar em contato com o hidróxido de lítio presente nos filtros ocorre a reação com o dióxido de carbono existente no ar. A reação global é exotérmica, formando carbonato de lítio sólido e água no estado gasoso.
Disponível em: <http://www.abq.org.br/cbq/2014/trabalhos/14/4463-18723.html>.
Analisando o texto e a reação não balanceada, assinale a alternativa CORRETA.
CO2(g) + LiOH(s) → Li2CO3(s) + H2O(v)
Em seu artigo “Mecanismos Redox de Compostos Aromáticos, Aminoácidos e Proteínas, em Eléctrodos de Carbono”, Teodor Adrian Enache, pesquisador da Faculdade de Ciências e Tecnologia, da Universidade de Coimbra, Portugal, discute a reação entre oxidação e aminoácidos.
Assinale a afirmação verdadeira a respeito dessa
reação.
