Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
A equação química a seguir representa a obtenção de glicose a partir do glicogênio.
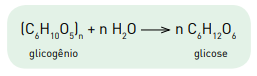
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona
o ganho de energia, em quilojoules, equivalente a:
(C6H10O) n + nH2O → n C6H12O6 glicogênio glicose
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a:
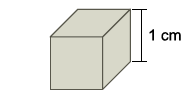
Deseja-se recobrir as faces desse cubo com uma camada uniforme de cobre de 1 × 10–2 cm de espessura. Para isso, o cubo pode ser utilizado como cátodo de uma cuba eletrolítica contendo íons Cu2+(aq). Admita que a eletrólise se realize sob corrente elétrica de 200 mA, que a constante de Faraday seja igual a 1 × 105 C/mol e que a densidade do cobre seja 9 g/cm3 . Assim, estima-se que o tempo de eletrólise necessário para que se deposite no cubo a camada de cobre desejada será próximo de

O Parque Eólico de Osório é o maior da América Latina e o segundo maior do mundo em operação. Com capacidade produtiva total de 150 MW, tem potência suficiente para abastecer anualmente o consumo residencial de energia elétrica de cerca de 650 mil pessoas. (www.osorio.rs.gov.br. Adaptado.)
Considere agora a combustão completa do metano, principal componente do gás natural, cuja entalpia de combustão completa é cerca de – 9 × 102 kJ/mol, e que as transformações de energia nessa combustão tenham eficiência ideal, de 100%.
Para fornecer a mesma quantidade de energia obtida pelo Parque Eólico de Osório quando opera por 1 hora com sua capacidade máxima, uma usina termoelétrica a gás necessitaria da combustão completa de uma massa mínima de metano da ordem de
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
Reação 1: 2 H2(g) → 4 H+ (aq) + 4e-
Reação 2: O2(g) + 4 H+ aq) + 4e- → 2 H2O(l)
Sobre células a combustível, marque a afirmação verdadeira.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
As2S3 +HNO3 + H2O → H3AsO4 + H2SO4 +NO,
marque a única afirmação verdadeira.
Considere que a massa molar do principal componente do biogás é 16 g/mol e que sua combustão completa produz 802 kJ/mol, nas condições experimentais. A quantidade de energia gerada ao final de um dia, em que houve a formação de 1 kg desse componente do biogás é
A queima de uma substância se dá pela reação de combustão entre um comburente e um combustível. Diversos produtos podem ser formados nesta reação, como H2O, CO2, CO, H2 e CH4. Alguns destes componentes podem causar a chuva ácida que prejudica o meio ambiente com danos aos ciclos biogeoquímicos do planeta e o agravamento do efeito estufa. A combustão completa de uma substância produz gás carbônico e água como produtos. Considere a reação de combustão completa do etileno mostrada abaixo.
C2H4 + 3O2 → 2CO2 + 2H2O
Considere as massas molares de C2H4, O2 e CO2 iguais a 28 g/mol, 32 g/mol e 44 g/mol, respectivamente e assinale a alternativa correta que apresenta quantos gramas de CO2 serão formados com uma massa inicial de C2H4 igual a 2g e de O2 igual a 6g e se a reação é endotérmica ou exotérmica.
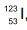 , e iodo-131,
, e iodo-131, 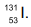 (http://www.cnen.gov.br/radiofarmacos. Adaptado)
(http://www.cnen.gov.br/radiofarmacos. Adaptado)
Os átomos de iodo-123 e iodo-131 possuem
Foi realizada uma experiência, denominada de “Vulcão de Dicromato”, cujo procedimento foi o seguinte:
1. Adicionou-se uma porção de dicromato de amônio sólido em um erlenmeyer de capacidade de 2L, que foi tampado em seguida.
2. Colocou-se o erlenmeyer contendo a porção de dicromato de amônio sólido para aquecer sobre uma chapa aquecedora.
3. Observou-se que, no início do aquecimento, a cor laranja do dicromato se acentuou, ficando mais escuro, com formação de fagulhas luminosas e, em seguida, ocorreram mudança de coloração do sólido para verde e saída intensa de luz, caracterizando a decomposição, por calor, do dicromato de amônio.
Com relação a essa experiência, é correto dizer que
I. A energia livre depende da temperatura.
II. Todas as reações exotérmicas são espontâneas.
III. Em uma reação química, a variação de entropia é sempre positiva.
IV. Em algumas reações químicas, a variação de entalpia coincide com a variação da energia interna.
V. A variação de entropia de uma reação espontânea pode ser negativa.
É correto somente o que se afirma em
I. É a aplicação de uma camada de cobre ou ligas de cobre sobre a superfície de aço ou ferro.
II. A finalidade da galvanização é formar uma capa protetora que evite a corrosão do metal.
III. O método mais usado de galvanização é o de imersão a quente.
IV. O metal utilizado na galvanização é conhecido como metal de sacrifício e tem maior poder de redução que o metal a ser protegido.
São verdadeiras somente as proposições
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
É dada a equação não balanceada: ZnS(s) + O2(g) → ZnO(s) + SO2(g) e conhecem-se os valores do calor de combustão do zinco = -108,85 kcal/mol, e dos calores de formação do ZnS = - 44,04 kcal/mol, e do SO2 = - 71,00 kcal/mol. Com essas informações, pode-se afirmar corretamente que o calor de formação do óxido de zinco será, em kcal/mol, aproximadamente
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
( ) Sua distribuição eletrônica é [Kr] 4f14 5d10 6s26p4 . ( ) Trata-se de um elemento transurânico. ( ) Sua radiação pode ser detida por uma folha de papel. ( ) Só é letal quando ingerido ou inalado. ( ) É mais eletronegativo do que o selênio e o telúrio.
A sequência correta, de cima para baixo, é:

