Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
Assinale a alternativa que contém o calor necessário para elevar a temperatura de 25,0 g de perclorato de potássio da temperatura ambiente até sua temperatura de fusão em 525°C. Dado: capacidade calorífica: 5,85 kJ K-1 mol-1 .

(Disponível em:<http://tirinhasdefisica.blogspot.com.br/>
As lâmpadas incandescentes, como as presentes na charge, foram progressivamente substituídas por outros tipos de menor consumo de energia elétrica.
Com base nos conhecimentos sobre reações de oxidação e redução e considerando que a rosca dessa lâmpada seja confeccionada em ferro (Fe(s)) e que esteja sendo utilizada em um ambiente úmido, assinale a alternativa correta.
(Valores dos potenciais padrão de redução: Cu2+/Cu(s) = +0,34 V;
Zn2+/Zn(s) = -0,76 V; Sn2+/Sn(s) = -0,14 V; Fe2+/Fe = -0,44 V;
Ag+/Ag(s) = +0,80 V; Mg2+/Mg(s) = -2,38 V)
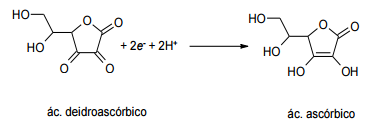
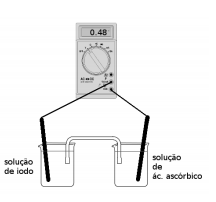 Sabendo que o potencial padrão de redução de iodo a iodeto é de E0 = 0,54 V,
o potencial padrão da reação abaixo é:
Sabendo que o potencial padrão de redução de iodo a iodeto é de E0 = 0,54 V,
o potencial padrão da reação abaixo é:
Dados – M (g mol-1 ): O = 16; Al = 27; Fe = 56.
A partir de 5 toneladas de minério, a quantidade (em toneladas) de alumínio metálico produzida por eletrólise ígnea é mais próxima de:
Numa sessão de estudos, alunos do Ensino Médio necessitavam responder a questão que tinha a seguinte informação: S(g) + 3/2 O2(g) → SO3(g) ΔH = -94,4Kcal/mol que é a equação termoquímica de um problema.
Pode-se afirmar que quando 120g de SO3(g) são formados: (Dado: S = 32g, O = 16g)
INSTRUÇÃO: Para responder à questão, considere o texto e a tabela a seguir.
A sociedade contemporânea vem usando combustíveis fósseis em grande escala, e isso está causando uma série de problemas ambientais. Um dos mais graves é a mudança climática que vem se desencadeando com o aumento da concentração de CO2 na atmosfera. Um modo de amenizar o problema, sem contudo solucioná-lo, seria dar preferência àqueles combustíveis fósseis que fornecem mais energia para uma mesma quantidade de CO2 produzido.
Tabela – Estruturas moleculares e entalpias de combustão de alguns compostos encontrados em combustíveis fósseis
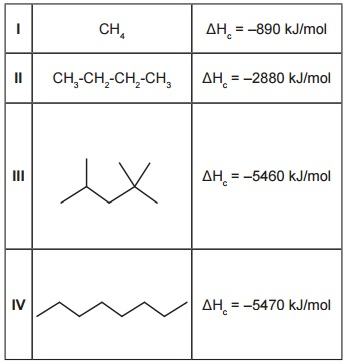
Com base nas informações, assinale a alternativa
correta:
INSTRUÇÃO: Para responder à questão, analise as informações a seguir.
Em embarcações pequenas com casco de aço, é comum e vantajoso evitar a corrosão pelo método da proteção catódica. Esse método consiste no emprego de placas de metais ou ligas metálicas, as quais, ao serem conectadas eletricamente ao casco, são capazes de gerar uma diferença de potencial suficiente para manterem o metal do casco reduzido. No aço, o principal processo de oxidação pode ser representado por:
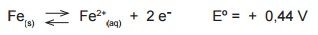
Considerando as informações, a equação associada
a um processo adequado de proteção catódica de um
casco de aço é:
INSTRUÇÃO: Para responder à questão, analise o texto a seguir.
O flúor-18 é um isótopo radioativo artificial muito usado em medicina nuclear. Uma das aplicações se dá no diagnóstico do câncer por meio da fluorodesoxiglicose (FDG) contendo 18F, que é uma versão modificada da molécula de glicose. Sabe-se que as células dos tumores cancerosos apresentam metabolismo mais rápido do que as células normais, por isso absorvem mais glicose do que as demais células. Administrando uma dose de FDG e monitorando onde há maior emissão radioativa, podem-se localizar os tumores no paciente. O flúor-18 apresenta meia-vida de 110 minutos e sofre decaimento radioativo, gerando oxigênio-18, que é estável.
A respeito desse assunto, é correto afirmar:


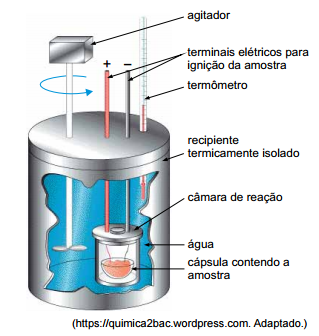
A tabela nutricional de determinado tipo de azeite de oliva traz a seguinte informação: “Uma porção de 13 mL (1 colher de sopa) equivale a 108 kcal.” Considere que o calor específico da água seja 1 kcal · kg–1 · ºC–1 e que todo o calor liberado na combustão do azeite seja transferido para a água. Ao serem queimados 2,6 mL desse azeite, em um calorímetro contendo 500 g de água inicialmente a 20,0 ºC e à pressão constante, a temperatura da água lida no termômetro deverá atingir a marca de
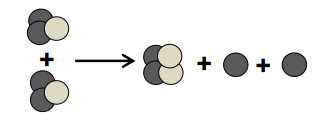
De acordo com esse esquema, pode-se concluir que essa transformação, que liberaria muita energia, é uma
Um belo exemplo de como a química está presente em todo lugar são os vaga-lumes, nos quais ocorre uma reação química do tipo bioluminescente que “acende” seus corpos, produzindo um lindo efeito com a participação do oxigênio que age como agente oxidante e, dessa forma, uma reação de oxidação-redução é responsável pela emissão de luz. Atente ao que se diz a esse respeito:
I. Em uma reação de oxidação-redução, todos os átomos passam por variação do número de oxidação.
II. Geralmente não há oxidação sem redução e vice-versa.
III. As reações de dupla troca são de oxidação-redução.
IV. As reações de combustão (queima na presença de oxigênio) são também processos redox.
V. Os termos oxidante e redutor costumam referir-se às espécies químicas, e não somente a determinado átomo.
Está correto o que se afirma somente em
Células a combustível são opções viáveis para gerar energia elétrica para motores e outros dispositivos. O esquema representa uma dessas células e as transformações que nela ocorrem.
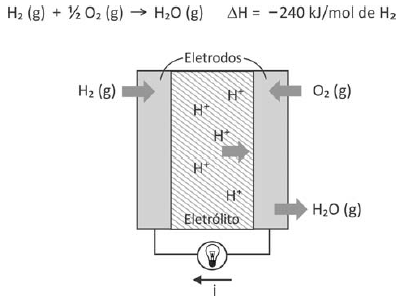
A corrente elétrica (i), em ampère (coulomb por segundo), gerada por uma célula a combustível que opera por 10 minutos e libera 4,80 kJ de energia durante esse período de tempo, é
Note e adote:
Carga de um mol de elétrons = 96.500 coulomb.
Sob certas condições, tanto o gás flúor quanto o gás cloro podem reagir com hidrogênio gasoso, formando,respectivamente, os haletos de hidrogênio HF e HCl, gasosos. Pode-se estimar a variação de entalpia (ΔH) de cada uma dessas reações, utilizando-se dados de energia deligação. A tabela apresenta os valores de energia de ligação dos reagentes e produtos dessas reações a 25 ºC e 1 atm.

Com base nesses dados, um estudante calculou a variação de entalpia (ΔH) de cada uma das reações e concluiu,corretamente, que, nas condições empregadas.
Um estudante realizou um experimento para avaliar a reatividade dos metais Pb, Zn e Fe. Para isso, mergulhou, em separado, uma pequena placa de cada um desses metais em cada uma das soluções aquosas dos nitratos de chumbo, de zinco e de ferro. Com suas observações, elaborou a seguinte tabela, em que (sim) significa formação de sólido sobre a placa e (não) significa nenhuma evidência dessa formação:

A seguir, montou três diferentes pilhas galvânicas, conforme esquematizado.

Nessas três montagens, o conteúdo do béquer I era uma solução aquosa de CuSO4 de mesma concentração, e essa solução era renovada na construção de cada pilha. O eletrodo onde ocorria a redução (ganho de elétrons) era o formado pela placa de cobre mergulhada em CuSO4 (aq). Em cada uma das três pilhas, o estudante utilizou, no béquer II, uma placa de um dos metais X (Pb, Zn ou Fe), mergulhada na solução aquosa de seu respectivo nitrato.
O estudante mediu a força eletromotriz das pilhas, obtendo os valores: 0,44 V; 0,75 V e 1,07 V.
A atribuição correta desses valores de força eletromotriz a
cada uma das pilhas, de acordo com a reatividade dos metais
testados, deve ser
No início do século XX, Pierre Curie e colaboradores, em uma
experiência para determinar características do recém-descoberto elemento químico rádio, colocaram uma
pequena quantidade desse material em um calorímetro e
verificaram que 1,30 grama de água líquida ia do ponto de
congelamento ao ponto de ebulição em uma hora. A
potência média liberada pelo rádio nesse período de tempo
foi, aproximadamente,
Note e adote:
Calor específico da água: 1 cal/(g ºC)
1 cal = 4 J
Temperatura de congelamento da água: 0 ºC
Temperatura de ebulição da água: 100 ºC
Considere que toda a energia emitida pelo rádio foi absorvida pela água
e empregada exclusivamente para elevar sua temperatura.

