Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
Substância ΔH combustão (kcal/mol) C2H4(g) -337,3 H2(g) -68,3 C2H6(g) -372,8
O valor da variação de entalpia na hidrogenação catalítica do eteno, descrita pela reação abaixo, é:
C2H4(g) + H2(g) → C2H6(g)
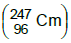 . O modo de decaimento do califórnio 251 é feito por:
. O modo de decaimento do califórnio 251 é feito por: HNO3(l) + SO2(g) + H2O(l) → H2SO4(l) + NO(g)
são feitas as seguintes afirmações:
I. O nitrogênio sofre redução. II. O enxofre ganha elétrons. III. O agente redutor é o SO2. IV. O agente oxidante é o HNO3.
São corretas as seguintes afirmativas:
O livro “As Garotas da Cidade Atômica” (Denise Kiernan), lançado em 2015, aborda a presença de mulheres anônimas, que passaram despercebidas pela história, recrutadas em todos os Estados Unidos para trabalharem na cidade secreta de Oak Ridge em troca de bons salários. A cidade era sede do Projeto Manhattan, codinome de um plano criado para enriquecer urânio e criar bombas para uso bélico.
Eram secundaristas, químicas, estatísticas e secretárias, que pouco ou nada sabiam sobre o real propósito do que faziam e do misterioso projeto. A finalidade só foi divulgada ao mundo após o lançamento das bombas atômicas sobre Hiroshima e Nagasaki, no Japão, em agosto de 1945.
Uma das possíveis reações de fissão nuclear, que ocorre na explosão da bomba atômica está representada a seguir:
92U235 + 0 n1 → 56 Ba141 + 36Kr 92 + 3 X + energia
Na equação apresentada, X representa a:
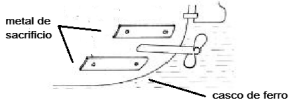 Fonte da figura: http://www.foz.unioeste.br/~lamat/downmateriais/materiaiscap9.pdf
adaptada).
Fonte da figura: http://www.foz.unioeste.br/~lamat/downmateriais/materiaiscap9.pdf
adaptada). Considerando a equação de redução do ferro: Fe+2 + 2e- → Fe° Eº = - 0,44 V Assinale a alternativa que apresenta um metal de sacrifício que poderia ser usado nas plaquetas fixadas ao casco do navio, de forma a proteger o ferro da oxidação.
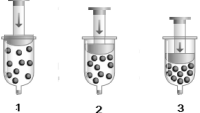
(Fonte Figura: Santos e Mól – Quimica Cidadã- 1ª série Editora AJS-SP(2011)).
Admitindo que o experimento tenha sido realizado em temperatura constante, pode-se afirmar que o gráfico que representa a transformação gasosa acima é:
I. NO(g) + 1/2 O2(g) → NO2(g) + 56.7kJ
II. 1/2 N2(g) + O2(g) → NO2(g) + 38,8Kj
III. 1/2 N2(g) + 1/2 O2(g) → NO(g)
De acordo com os estudos de Germain Henry Hess, professor da Universidade de São Petersburgo, no século XIX, a variação de entalpia em uma reação química depende apenas dos estados inicial e final de reagentes e de produtos da reação. A Lei de Hess contribuiu para o nascimento do princípio da conservação de energia.
A partir da aplicação da Lei de Hess, ao sistema de equações
termoquímicas I e II, é possível calcular a variação de entalpia
da reação representada pela equação química III.
Dessa forma, é correto afirmar:

 Disponível em: http://sciencewatch.com/ Adaptado
Disponível em: http://sciencewatch.com/ Adaptado Geradores desse tipo
Analise o fenômeno representado ao lado.
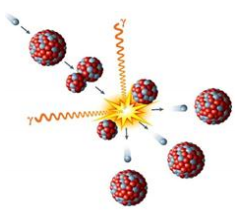
Fonte: Ilustração: Peter Hermes Furian / Shutterstock.com
Uma aplicação desse fenômeno é verificada na
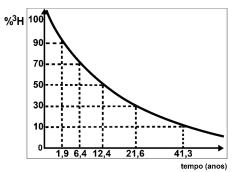 Disponível em: http://qa.ff.up.pt/radioquimica/rq-tp/rq-tp03.pdf. Adaptado
Disponível em: http://qa.ff.up.pt/radioquimica/rq-tp/rq-tp03.pdf. Adaptado Quantos anos possui uma amostra de água retirada de um lençol freático cuja concentração de hélio-3 é nove vezes superior à quantidade de trítio?
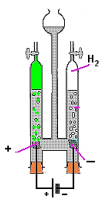
Fonte: http://www.docbrown.info/page01/ExIndChem/electrochemistry03.htm. Adaptado
A substância produzida no ânodo é um

Considerando a relação da energia reticular, U ou ∆Hºreticular, do cloreto de sódio com outros dados termoquímicos, é CORRETO afirmar que, para
Considere a sequência das substâncias em soluções ácidas.
SO42- → S2O62- → SO2 → S2O32- → S8.
O enxofre apresenta, respectivamente, maior e menor número de oxidação em:
MnO-4(aq) + H+(aq) + H2O2((aq) → Mn2+(aq) + H2O(ℓ) + O2(g)
O peróxido de hidrogênio, H2O2(ℓ), é um líquido incolor espesso, empregado como antisséptico e alvejante, a depender da concentração. Ao reagir com algumas substâncias, o peróxido de hidrogênio pode atuar como oxidante ou redutor. A equação química não balanceada representa a reação do íon permanganato com o peróxido de hidrogênio.
A partir dessas informações e após o balanceamento dessa
equação química com os menores coeficientes
estequiométricos inteiros, é correto afirmar:

O diagrama representa a entalpia de formação do pentacloreto de fósforo a partir de duas variedades alotrópicas de fósforo, o fósforo branco e o fósforo vermelho.
A partir da análise desse diagrama, é correto afirmar:
Com o passar do tempo, e o seu uso, jóias de prata perdem seu aspecto brilhante, tornando-se escuros. Isso ocorre porque os átomos de prata da superfície do objeto reagem com compostos de enxofre presentes no suor, formando uma película escura de sulfeto de prata. Esta película pode ser removida colocando-se o objeto escurecido em uma panela de alumínio contendo bicarbonato de sódio. O alumínio reage com a prata presente na película, transformando-se no cátion alumínio. Esse processo é acelerado em água quente. As semi reações deste processo são dadas por:
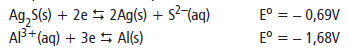
Considerando a reação de oxi-redução, assinale a alternativa correta.
Na Medicina Nuclear, existem duas modalidades: o diagnóstico e o tratamento. Nas doenças da tireoide, por exemplo, uma das formas de diagnóstico por imagem é por meio do exame de cintilografia. O exame usa iodo-123, que é emissor de raios gama e possui meia vida de 13 horas, visto que o radioisótopo mapeia a tireoide ao se acumular em seu tecido. Já para o tratamento, é utilizado o iodo-131, que emite raios beta e possui meia vida de 8 dias, uma vez que a radiação emitida por ele destrói as células doentes.
Dado: 53I123 53I131
Sobre o iodo e as informações citadas, assinale a afirmação CORRETA.
O esquema abaixo representa uma célula eletroquímica.
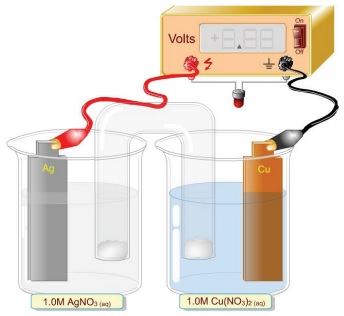
Sabendo -se que os potenciais padrão de oxidação a 25°C são:

H(g) + Cl(g) - 431.Kj → HCl(g) Hidrogênio
 Cloro
Cloro  Cloreto de Hidrogênio
Cloreto de Hidrogênio 

Em relação às combinações do hidrogênio com o cloro, é CORRETO afirmar que: