Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 985 questões
Dados:
Massa atômica: C = 12 O = 16 Cgrafite + O2(g) → CO2(g) ΔH= - 393,5 kJ/mol Cdiamante + O2(g) → CO2(g) ΔH= - 395,4 kJ/mol
I. Alumínio II. Ferro III. Níquel IV. Cobre V. Prata
Assinale a alternativa que apresenta somente materiais em que a solução pode ser armazenada sem ocorrência de reação com o recipiente:
Dados:
Al3+(aq) + 2e- → Al(s) E°=-1,66 V Fe2+(aq) + 2e- → Fe(s) E°=-0,44 V Ni2+(aq) + 2e- → Ni(s) E°=-0,25 V Co2+(aq) + 2e- → Co(s) E°=-0,28 V Cu2+(aq) + 2e- → Cu(s) E°=+0,34 V Ag+(aq) + 2e- → Ag(s) E°=+0,80 V

I. (CH2O)n + O2 → CO2 + H2O + Energia II. H2O + CO2 + hν → (CH2O)n + O2
Sobre os processos, é CORRETO afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Apressão de vapor é uma importante propriedade físico-química das substâncias e das soluções.
Com base nos dados fornecidos e nos conhecimentos de química, é correto afirmar:
C6H4(OH)2(aq) + H2O2
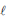 ) hidroquinona
) hidroquinona O calor envolvido nessa transformação pode ser calculado, considerando-se os processos:
C6H4(OH)2(aq) → C6H4O2(aq) + H2(g) ΔHº = + 177 kJ . mol-1
H2O (
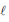 ) + 1/2 O (g) → H2O2 (aq) ΔHº= + 95 kJ .mol-1
) + 1/2 O (g) → H2O2 (aq) ΔHº= + 95 kJ .mol-1
H2O(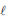 ) → 1/2 O2(g) + H2 (g) ΔHº= + 286 kJ .mol-1
) → 1/2 O2(g) + H2 (g) ΔHº= + 286 kJ .mol-1
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2
I. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔHo= −212,8kcalmol−1 II. CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
( ) A partir dos métodos do calor de formação e da energia de ligação, obtêm-se os mesmos valores de variação de entalpia da reação expressa na equação química I. ( ) A queima de alcanos só é exotérmica se os produtos forem gasosos. ( ) A reação expressa na equação química II é mais exotérmica que aquela expressa na equação química I. ( ) O calor da reação expressa na equação química II equivale à soma do calor de vaporização da água com o calor envolvido na reação expressa na equação química I.
A alternativa que contém a sequência correta, de cima para baixo, é a

Quem tem medo da radioatividade?
Como herança da destruição causada pela explosão das bombas atômicas ao fim da Segunda Guerra, a energia nuclear ganhou uma reputação difícil de mudar. Um novo livro desmistifica a radioatividade e aponta as vantagens e desvantagens de seu uso. Foram mais de cem mil mortos imediatamente após a explosão das bombas nucleares em Hiroshima e Nagasaki, em agosto de 1945. Ironicamente, as mesmas propriedades do átomo capazes de causar tamanha destruição também podiam salvar vidas se empregadas no tratamento de câncer. A radioterapia, o exame de raios-X e o marca-passo artificial são exemplos de aplicações pacíficas da radioatividade. Para muitos, no entanto, a função da energia nuclear se resume a dizimar vidas. O temor suscitado pelos cogumelos atômicos se espalhou pelo mundo e ecoa até hoje devido à falta de informações precisas sobre o tema.
O risco de acidentes e a destinação do lixo nuclear
são tratados de forma esclarecedora, ao se
destacarem as aplicações da tecnologia nuclear
na medicina molecular, na agricultura, na
indústria e na datação de artefatos na
arqueologia, e tudo que envolve a geração de
energia nas usinas nucleares, como alternativa à
queima de combustíveis fósseis das usinas
termelétricas de gás e carvão e ao impacto
socioambiental das hidrelétricas. Os fantasmas
associados às usinas nucleares – o risco de
acidentes e a destinação do lixo nuclear – são
tratados de forma esclarecedora pelos
pesquisadores sobre a radioatividade. (VENTURA,
2017);

Quem tem medo da radioatividade?
Como herança da destruição causada pela explosão das bombas atômicas ao fim da Segunda Guerra, a energia nuclear ganhou uma reputação difícil de mudar. Um novo livro desmistifica a radioatividade e aponta as vantagens e desvantagens de seu uso. Foram mais de cem mil mortos imediatamente após a explosão das bombas nucleares em Hiroshima e Nagasaki, em agosto de 1945. Ironicamente, as mesmas propriedades do átomo capazes de causar tamanha destruição também podiam salvar vidas se empregadas no tratamento de câncer. A radioterapia, o exame de raios-X e o marca-passo artificial são exemplos de aplicações pacíficas da radioatividade. Para muitos, no entanto, a função da energia nuclear se resume a dizimar vidas. O temor suscitado pelos cogumelos atômicos se espalhou pelo mundo e ecoa até hoje devido à falta de informações precisas sobre o tema.
O risco de acidentes e a destinação do lixo nuclear
são tratados de forma esclarecedora, ao se
destacarem as aplicações da tecnologia nuclear
na medicina molecular, na agricultura, na
indústria e na datação de artefatos na
arqueologia, e tudo que envolve a geração de
energia nas usinas nucleares, como alternativa à
queima de combustíveis fósseis das usinas
termelétricas de gás e carvão e ao impacto
socioambiental das hidrelétricas. Os fantasmas
associados às usinas nucleares – o risco de
acidentes e a destinação do lixo nuclear – são
tratados de forma esclarecedora pelos
pesquisadores sobre a radioatividade. (VENTURA,
2017);
Para explicar a produção de dióxido de carbono, as seguintes afirmações foram feitas.
I. Tanto o fermento químico quanto o biológico reagem com os carboidratos presentes na massa culinária, sendo o dióxido de carbono um dos produtos dessa reação.
II. O hidrogenocarbonato de sódio, presente no fermento químico, pode se decompor com o aquecimento, ocorrendo a formação de carbonato de sódio (Na2CO3), água e dióxido de carbono.
III. As leveduras, que formam o fermento biológico, metabolizam os carboidratos presentes na massa culinária, produzindo, entre outras substâncias, o dióxido de carbono.
IV. Para que ambos os fermentos produzam dióxido de carbono, é necessário que a massa culinária seja aquecida a temperaturas altas (cerca de 200 ºC), alcançadas nos fornos domésticos e industriais.
Dessas afirmações, as que explicam corretamente a produção de dióxido de carbono pela adição de fermento à massa culinária são, apenas,
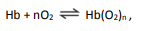
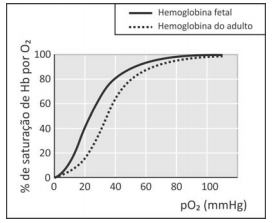
em que Hb representa tanto a hemoglobina do adulto quanto a hemoglobina fetal.
A figura mostra a porcentagem de saturação de Hb por O2 em função da pressão parcial de oxigênio no sangue humano, em determinado pH e em determinada temperatura.
A porcentagem de saturação pode ser entendida como :
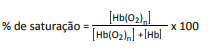
Com base nessas informações, um estudante fez as seguintes afirmações:
I. Para uma pressão parcial de O2 de 30 mmHg, a hemoglobina fetal transporta mais oxigênio do que a hemoglobina do adulto.
II. Considerando o equilíbrio de transporte de oxigênio, no caso de um adulto viajar do litoral para um local de grande altitude, a concentração de Hb em seu sangue deverá aumentar, após certo tempo, para que a concentração de Hb(O2)n seja mantida.
III. Nos adultos, a concentração de hemoglobina associada a oxigênio é menor no pulmão do que nos tecidos.
É correto apenas o que o estudante afirmou em
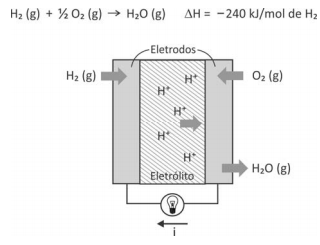
A corrente elétrica (i), em ampère (coulomb por segundo), gerada por uma célula a combustível que opera por 10 minutos e libera 4,80 kJ de energia durante esse período de tempo , é
Sob certas condições, tanto o gás flúor quanto o gás cloro
podem reagir com hidrogênio gasoso, formando,
respectivamente, os haletos de hidrogênio HF e HCl,
gasosos. Pode-se estimar a variação de entalpia  de cada
uma dessas reações, utilizando-se dados de energia de
ligação. A tabela apresenta os valores de energia de ligação
dos reagentes e produtos dessas reações a 25 ºC e 1 atm.
de cada
uma dessas reações, utilizando-se dados de energia de
ligação. A tabela apresenta os valores de energia de ligação
dos reagentes e produtos dessas reações a 25 ºC e 1 atm.

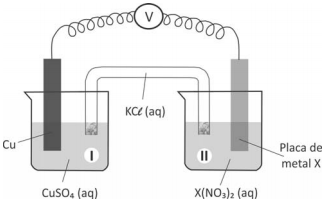
Com base nesses dados, um estudante calculou a variação
de entalpia 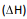 de cada uma das reações e concluiu,
corretamente, que, nas condições empregadas,
de cada uma das reações e concluiu,
corretamente, que, nas condições empregadas,
I. Se tivesse ocorrido apenas combustão incompleta, restaria propano no reator. II. Para que todo o propano reagisse, considerando a combustão completa, seriam necessários, no mínimo, 750 L de ar. III. É provável que, nessa combustão, tenha se formado fuligem.
Está correto apenas o que se afirma
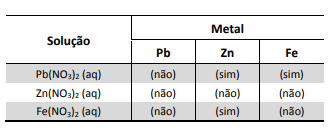
A seguir, montou três diferentes pilhas galvânicas, conforme esquematizado.
Nessas três montagens, o conteúdo do béquer I era uma solução aquosa de CuSO4 de mesma concentração, e essa solução era renovada na construção de cada pilha. O eletrodo onde ocorria a redução (ganho de elétrons) era o formado pela placa de cobre mergulhada em CuSO4 (aq). Em cada uma das três pilhas, o estudante utilizou, no béquer II, uma placa de um dos metais X (Pb, Zn ou Fe), mergulhada na solução aquosa de seu respectivo nitrato.
O estudante mediu a força eletromotriz das pilhas, obtendo os valores: 0,44 V; 0,75 V e 1,07 V. A atribuição correta desses valores de força eletromotriz a cada uma das pilhas, de acordo com a reatividade dos metais testados, deve se