Questões de Vestibular
Sobre transformações químicas e energia em química
Foram encontradas 975 questões
2 PH3 (g) + 4 O2 (g) → P2O5 (g) + 3 H2O (g)
As substâncias que atuam como agente oxidante e agente redutor desse processo são, respectivamente,
Entre os gráficos 1, 2 e 3, aquele que representa corretamente a reação da fosfina com o oxigênio, descrita no texto, é o
Leia o texto para responder a questão.
De onde vem o cheiro de carro novo?
De acordo com o gerente de uma montadora de veículos, o cheiro é composto por uma combinação de vários tipos de substâncias químicas usadas na fabricação do veículo, incluindo solventes, plásticos, colas, tecidos e borracha. Porém, muitas delas são altamente tóxicas, porque contêm Compostos Orgânicos Voláteis (COVs) em sua composição, como benzeno, tolueno e formol, que podem ser letais dependendo da quantidade. Eles acabam escapando e impregnando o ar, porque não requerem altas temperaturas para evaporarem.
<http://tinyurl.com/y8ucob6c> Acesso em: 13.11.2017. Adaptado.
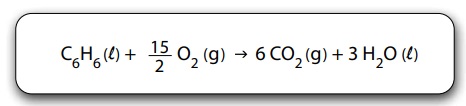
A entalpia de combustão do benzeno pode ser determinada conhecendo-se os valores das entalpias de formação do gás carbônico, assim como da água e do benzeno líquidos.
A tabela apresenta os valores de entalpia de formação de algumas substâncias nas condições padrão.
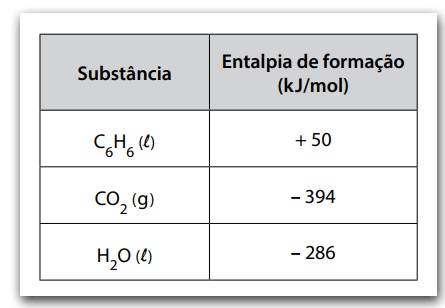
A entalpia de combustão completa do benzeno, em kJ/mol, é
Observe a reação abaixo, que representa a adição de uma solução de permanganato de potássio em uma solução de ácido clorídrico.
KMnO4(aq) + HCI(aq) → KCI(aq) + MnCI2(aq) + CI2(g) + H2O(I)
O coeficiente estequiométrico do ácido clorídrico
da reação balanceada é
Uma pilha é formada por uma célula de Ag/Ag+ e outra célula de Zn/Zn2+ , ligadas por uma ponte salina. O potencial padrão da pilha é:
Dados:
Eo Red Ag+ /Ag = +0,80 V
Eo
Red Zn2+/Zn = -0,76 V
A crescente contaminação ambiental pelas indústrias tem sido combatida com o desenvolvimento de novas técnicas de tratamento de efluentes tóxicos. O processo Fenton, conforme reação 1 a seguir, é um dos procedimentos utilizados no tratamento de efluentes orgânicos.
Reação 1: Fe2+(aq) + H2O2(aq) → Fe3+(aq) + OH−(aq) + OH• (aq) k = 76 (mol L−1) −1 s−1
Na reação 1, há a formação de OH• (radical hidroxila) com potencial oxidante superior ao H2O2. Assim, a eficiência deste processo se dá pela produção de OH•, capaz de oxidar uma ampla variedade de compostos orgânicos gerando CO2, H2O e íons inorgânicos provenientes de heteroátomos. Além da reação 1, é possível ocorrer a reação 2, em que há a formação de HO2•, que, por sua vez, é um oxidante menos reativo que o OH•, diminuindo assim a eficiência do processo Fenton.
Reação 2: H2O2(aq) + OH• (aq) → HO2•(aq) + H2O(l) k = 2,7 x 107 (mol L−1) −1 s−1
Considerando as reações químicas envolvidas e os fatores que podem influenciar na eficiência do processo e com base nos conhecimentos sobre equilíbrio químico cinética química e eletroquímica, assinale a alternativa correta.
A hipoglicemia é caracterizada por uma concentração de glicose abaixo de 0,70 g L−1 no sangue. O quadro de hipoglicemia em situações extremas pode levar a crises convulsivas, perda de consciência e morte do indivíduo, se não for revertido a tempo. Entretanto, na maioria das vezes, o indivíduo, percebendo os sinais de hipoglicemia, consegue reverter este déficit, consumindo de 15 a 20 gramas de carboidratos, preferencialmente simples, como a glicose.
A metabolização da glicose, C6H12O6, durante a respiração, pode ser representada pela equação química de combustão:
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l)
No quadro a seguir, são informadas reações químicas e seus respectivos calores de formação a 25 °C e 1 atm:

Sabendo que a Massa Molar (MM) da glicose é igual a 180,0 g mol−1, determine a quantidade aproximada de energia
liberada em kJ mol−1 no estado padrão, ΔHr°, na combustão da glicose, consumida em 350 mL de refrigerante
do tipo Cola, o qual possui, em sua composição, 35 g de glicose.
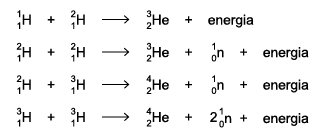
Estima-se que, a cada segundo, 657 milhões de toneladas de hidrogênio estejam produzindo 653 milhões de toneladas de hélio. Supõe-se que a diferença, 4 milhões de toneladas, equivalha à energia liberada e enviada para o espaço.
(Angélica Ambrogi et al. Unidades modulares de química, 1987. Adaptado.)
Sobre a situação apresentada no texto foram feitas três afirmações:
I. A quantidade de energia enviada para o espaço a cada segundo, equivalente a aproximadamente 4 milhões de toneladas de hidrogênio, pode ser estimada pela equação de Einstein, E = mc2 .
II. Todas as reações de fusão nuclear representadas são endotérmicas.
III. No conjunto das equações apresentadas, nota-se a presença de 3 isótopos do hidrogênio e 2 do hélio.
É correto o que se afirma somente em
As pilhas são dispositivos que receberam esse nome porque a primeira pilha inventada por Alessandro Volta, no ano de 1800, e era formada por discos de zinco e cobre separados por um algodão embebido em salmoura. Tal conjunto era colocado de forma intercalada, um em cima do outro, empilhando os discos e formando uma grande coluna. Como era uma pilha de discos, começou a ser chamada por esse nome.
Afirma-se que, numa pilha eletroquímica, sempre ocorre
I oxidação no ânodo.
II movimentação de elétrons no interior da solução eletrolítica.
III passagem de elétrons, no circuito externo, do cátodo para o ânodo.
IV uma reação de oxirredução.
São verdadeiras apenas as afirmações estabelecidas em:
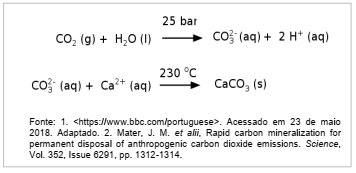
A usina de energia de Hellisheidi, na Islândia, vem testando um novo método para combater o aquecimento global: transformar o gás carbônico (CO2) em pedra. O processo ocorre em duas etapas: primeiro o CO2 é dissolvido em água em altas pressões (25 bar) e depois injetado no solo numa temperatura de 230 °C. A mineralização do gás carbônico ocorre de maneira rápida, devido à reatividade e composição do solo da região, rica em ferro, cálcio e magnésio. As duas etapas da remoção de CO2 estão esquematizadas de maneira simplificada ao lado.
A remoção desse gás da atmosfera ocorre por:
As transformações químicas ocorrem todo o tempo ao nosso redor,por exemplo, é muito comum notarmos que materiais metálicos como cercas, portões, pregos, entre outros, ao ficarem expostos ao ambiente, acabam se deteriorando. Isso ocorre devido ao contato do elemento químico ferro (Fe) com átomos de oxigênio (O) presentes no ar atmosférico e na água. Podemos notar também que em regiões litorâneas esses materiais sofrem ainda mais danos devido à presença de sais e uma maior umidade. Esse fenômeno é conhecido como ferrugem e ocorre devido a uma reação de oxirredução.
Disponível em:<https://www.infoescola.com/quimica/ferrugem/>. Acesso em: 01/04/2018.
A equação global que representa a formação de ferrugem é descrita abaixo:
2Fe(s) + O2(g) + 2H2O(l) → 2Fe(OH)2(s)
De acordo com a equação química, podemos concluir que:
Na corrosão de metais, ocorre a deterioração do material devido a uma reação de oxirredução do metal com o meio. O ferro, por exemplo, é facilmente oxidado quando exposto ao ar e à umidade, formando o óxido de ferro mono-hidratado (Fe2O3 . H2O), conhecido como ferrugem, conforme a reação balanceada a seguir:
2 Fe + 1,5 O2 + H2O → Fe2O3 . H2O
Sabendo que um pedaço de 10,0g de ferro foi exposto ao ar e à umidade, oxidando-se totalmente, qual a massa, aproximada, de ferrugem formada?
Dados de massas atômicas: H= 1,0u; O= 16,0u; Fe= 55,8u.
Considere as seguintes semirreações de redução.

Assinale com V (verdadeiro) ou F (falso) as afirmações abaixo.
( ) O cálcio, em uma pilha de cálcio e cobalto, é o ânodo.
( ) Uma reação entre cálcio metálico e íons zinco é espontânea.
( ) O metal mais reativo, entre os três, é o cobalto.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é:
De acordo com a Lei de Hess, a variação de entalpia de uma reação depende apenas dos estados inicial e final.
Considere as afirmações abaixo, sobre a Lei de Hess.
I - A reação reversa de uma reação endotérmica é sempre exotérmica.
II - A reação de combustão de um açúcar produzindo CO2 e água terá a mesma variação de entalpia, caso ocorra em um calorímetro ou no organismo humano.
III- Um catalisador adequado propicia um caminho com menor diferença de entalpia entre reagente e produtos.
Quais estão corretas?

