Questões de Vestibular
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 268 questões
Marque a opção correta:
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Considerando apenas a equação I, a velocidade de formação do N2 é igual a 3 mol/s.
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes informações:
Expressão de equilíbrio:
H2C 
Dados termodinâmicos (a 298 K):
Keq=7,5 x 107
∆H0 = -84,1 kJ mol-1
Ea= 140 kJ mol-1

O fato da reação apresentar ∆H<0 indica que a velocidade de obtenção do CH3CH2Br é alta.
Experi- [NO]0 (mol.L-1 ) [O2]0 (mol.L-1 ) Velocidade da reação Temperatura(ºC) mento (mol.L-1 .s-1 ) 1 0,020 0,010 1,0 . 10-4 400 2 0,040 0,010 4,0 . 10-4 400 3 0,020 0,040 4,0 . 10-4 400 4 0,020 0,040 16,0 . 10-4 ???
Analisando a tabela, é correto afirmar que
A reação de escurecimento em frutas, vegetais e sucos de frutas é um dos principais problemas na indústria de alimentos. Estima-se que em torno de 50% da perda de frutas tropicais no mundo é devida à enzima polifenol oxidase – PFO, que provoca a oxidação dos compostos fenólicos naturais presentes nos alimentos, causa a formação de pigmentos escuros – frequentemente acompanhados de mudanças indesejáveis na aparência e nas propriedades organolépticas do produto – resultando na diminuição da vida útil e do valor de mercado.
Várias maneiras de inibição da polifenol oxidase são conhecidas. Essa inibição é desejável e muitas vezes necessária para evitar o aparecimento de sabor desagradável e toxidez, como também por questões econômicas. Três componentes devem estar presentes para que a reação de escurecimento enzimático ocorra: enzima, substrato e oxigênio. No caso de ausência ou bloqueio da participação de um destes na reação química (seja por agentes redutores, diminuição de temperatura ou abaixamento de pH), a “velocidade” de reação diminui significativamente. O pH ótimo de atuação da PFO está entre 6 e 7, e abaixo de 3 não há nenhuma atividade enzimática.”
Adaptado de CARVALHO; LUPETTI; FATIBELLO-FILHO. Química Nova na Escola, n. 22, 2005.
A partir da leitura do texto acima e considerando as contribuições da ciência e tecnologia no campo da produção alimentícia, assinale a alternativa correta.
HBr(g) + NO2(g) → HBrO(g) + NO(g) (lenta) HBr(g) + HBrO(g) → Br2(g) + H2O(g) (rápida)
A partir do mecanismo proposto, é correto afirmar:
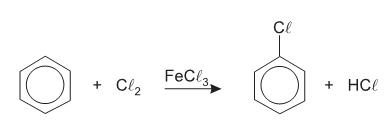
De acordo com esta reação, é CORRETO afirmar que:
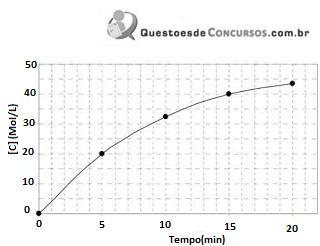
Para este experimento, qual dos gráficos abaixo melhor representa o comportamento dos íons na solução durante o processo. Considere t = tempo em minuto e concentração [ ] = mol/L
Na tabela a seguir, são apresentadas informações contidas na bula de comprimidos sólidos de ibuprofeno.
cada comprimido contém
ibuprofeno____|___ 300 mg
excipientes ___|___ ácido cítrico, benzoato de sódio,dióxido de titânio e amido
Assinale a opção que apresenta o gráfico que melhor representa a variação da temperatura em função do tempo para um comprimido que tenha a composição mostrada na tabela e tenha sido macerado e aquecido.
Considerando-se que a curva a seguir represente a variação da concentração de C em função do tempo para a reação química A + 3B ? 2C, é correto afirmar que, no intervalo de 0 a 5 min, a velocidade média da reação é 2,0 mol/L min.
( ) O processo que ocorre no cano de descarga dos veículos automotivos é uma catálise homogênea.
( ) Óxidos de nitrogênio, oriundos das descargas dos veículos, são responsáveis pela névoa fotoquímica.
( ) O conversor catalítico oxida o CO e hidrocarbonetos não queimados, transformando-os em dióxido de carbono e água.
( ) O conversor catalítico reduz os óxidos de nitrogênio a nitrogênio gasoso.
( ) Os conversores catalíticos eliminam totalmente a poluição atmosférica causada pelos gases liberados na descarga dos veículos automotivos.
A sequência correta, de cima para baixo, é
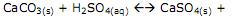
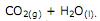 A reação se torna mais agressiva por sofrer um natural deslocamento para a direita. Apenas com as informações disponíveis na equação acima, marque a alternativa que contempla a explicação para esse fato.
A reação se torna mais agressiva por sofrer um natural deslocamento para a direita. Apenas com as informações disponíveis na equação acima, marque a alternativa que contempla a explicação para esse fato. 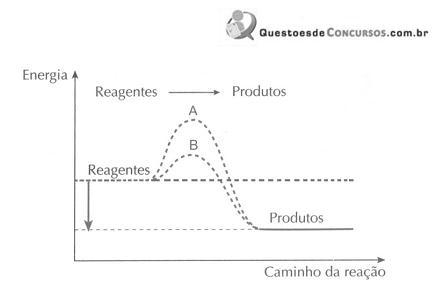
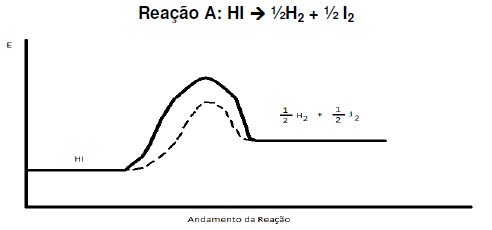
Analisando o diagrama, pode-se afirmar que:
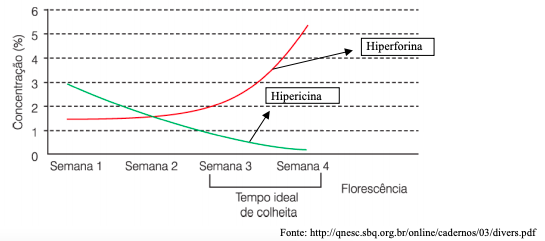
Com base nas informações citadas no texto e no gráfico, podemos afirmar que:
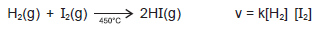
O modelo da teoria das colisões, que resultou de estudos dos fatores que influem na velocidade das reações químicas, é uma explicação para o modo como as moléculas de reagentes são clivadas e são formadas as moléculas de produtos de uma reação química.
Admitindo-se a reação química elementar entre o hidrogênio e o iodo, a 450°C, representada pela equação química, a expressão da lei de velocidade dessa reação, e com base na teoria das colisões, para que essa reação ocorra, dentre outros fatores, é preciso que
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
A velocidade de uma reação química é geralmente expressa em termos de variação de entalpia por unidade de tempo.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Catalisadores são agentes que aumentam as velocidades das reações, afetando os tipos de colisões (mecanismos) que levam à reação.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
O aumento da temperatura faz aumentar a energia das moléculas e, à medida que as moléculas movem-se mais velozmente, elas se chocam com maior frequência e também com energia mais alta, ocasionando um aumento na velocidade da reação.


