Questões de Vestibular
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 266 questões
Os expoentes na lei da velocidade de uma reação química, denominados ordem de reação, indicam como a velocidade é afetada pela concentração de cada reagente.
Assim, a partir dessas informações, da equação química de decomposição de N2O5(g) e da expressão da velocidade dessa reação, é correto afirmar:
Considere as seguintes afirmações sobre velocidade das reações químicas:
I. ela é proporcional à temperatura.
II. ela não depende da concentração dos reagentes.
III. ela é afetada pela presença de um catalisador.
A afirmação está INCORRETA em:
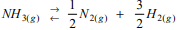 que possui uma energia de
ativação de 150 kJ mol-1 e uma variação de entalpia ∆H = 46 kJ mol-1
.
que possui uma energia de
ativação de 150 kJ mol-1 e uma variação de entalpia ∆H = 46 kJ mol-1
. A energia de ativação da formação da amônia é:
A figura ilustra a cinética de uma reação química com e sem a presença de catalisador.
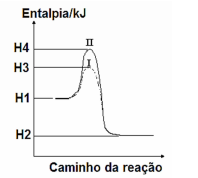
Numere a segunda coluna de acordo com a primeira coluna e, a seguir, assinale a sequência CORRETA encontrada.
1. H1 ( ) Energia liberada pela reação
2. H2 ( ) Energia de ativação da reação catalisada
3. H2-H1 ( ) Energia de ativação da reação não catalisada
4. H3-H1 ( ) Energia dos produtos
5. H4-H1 ( ) Energia dos reagentes
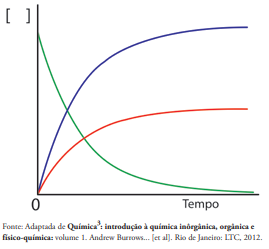
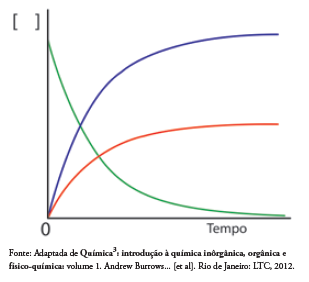
Considerando a reação de decomposição do peróxido de hidrogênio e o gráfico representado ao lado, avalie as afirmativas apresentadas abaixo e assinale a alternativa CORRETA.
I. A curva em verde representa o consumo de peróxido de hidrogênio.
II. A curva em azul representa a produção de oxigênio.
III. A velocidade média de decomposição da água oxigenada pode
ser representada por: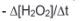
Considerando a reação de decomposição do peróxido de hidrogênio e o gráfico representado abaixo, avalie as afirmativas apresentadas abaixo e assinale a alternativa CORRETA.
I. A curva em verde representa o consumo de peróxido de hidrogênio. II. A curva em azul representa a produção de oxigênio. III. A velocidade média de decomposição da água oxigenada pode ser representada por: -Δ[H2O2]/ Δt
A reação de escurecimento em frutas, vegetais e sucos de frutas é um dos principais problemas na indústria de alimentos. Estima-se que em torno de 50% da perda de frutas tropicais no mundo é devida à enzima polifenol oxidase – PFO, que provoca a oxidação dos compostos fenólicos naturais presentes nos alimentos, causa a formação de pigmentos escuros – frequentemente acompanhados de mudanças indesejáveis na aparência e nas propriedades organolépticas do produto – resultando na diminuição da vida útil e do valor de mercado.
Várias maneiras de inibição da polifenol oxidase são conhecidas. Essa inibição é desejável e muitas vezes necessária para evitar o aparecimento de sabor desagradável e toxidez, como também por questões econômicas. Três componentes devem estar presentes para que a reação de escurecimento enzimático ocorra: enzima, substrato e oxigênio. No caso de ausência ou bloqueio da participação de um destes na reação química (seja por agentes redutores, diminuição de temperatura ou abaixamento de pH), a “velocidade” de reação diminui significativamente. O pH ótimo de atuação da PFO está entre 6 e 7, e abaixo de 3 não há nenhuma atividade enzimática.”
Adaptado de CARVALHO; LUPETTI; FATIBELLO-FILHO. Química Nova na Escola, n. 22, 2005.
A partir da leitura do texto acima e considerando as contribuições da ciência e tecnologia no campo da produção alimentícia, assinale a alternativa correta.
decomposição térmica do éter dimetílico ocorre de acordo com a equação:
CH3 -O-CH3(g) → CH4(g)+ H2(g) + CO(g).
Em determinadas condições de temperatura e pressão, essa reação apresenta a seguinte relação entre a concentração do éter e a velocidade inicial:
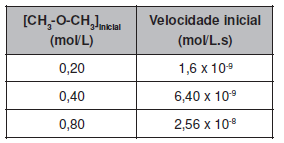
A partir desses dados, é correto afirmar que
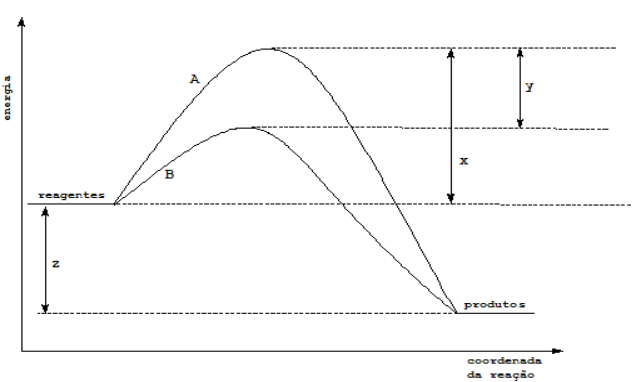
Pela análise do gráfico, pode-se afirmar que

A figura acima ilustra a alquilação de Friedel-Crafts, uma reação de substituição eletrolítica que ocorre entre um anel aromático e um cloreto de alquila. O AlCl3 é o catalisador mais usualmente empregado nesse tipo de reação. Conforme mostrado na reação a seguir, o AlCl3 liga-se ao cloro do cloreto de alquila e libera um carbocátion, que será o responsável pelo ataque eletrofílico ao anel aromático.

Considerando, além das informações do texto e da tabela acima, que as alquilações de Friedel-Crafts sejam de ordem um com relação ao composto aromático e de ordem um com relação ao cloreto de alquila, e que o grupo –OH seja um orientador orto/para dirigente, julgue o item subsequente.
Na presença do AlCl3, a reação se processa por um caminho
que envolve menor energia de ativação quando comparada à
reação não catalisada.

A figura acima ilustra a alquilação de Friedel-Crafts, uma reação de substituição eletrolítica que ocorre entre um anel aromático e um cloreto de alquila. O AlCl3 é o catalisador mais usualmente empregado nesse tipo de reação. Conforme mostrado na reação a seguir, o AlCl3 liga-se ao cloro do cloreto de alquila e libera um carbocátion, que será o responsável pelo ataque eletrofílico ao anel aromático.

Considerando, além das informações do texto e da tabela acima, que as alquilações de Friedel-Crafts sejam de ordem um com relação ao composto aromático e de ordem um com relação ao cloreto de alquila, e que o grupo –OH seja um orientador orto/para dirigente, julgue o item subsequente.
Considere que a alquilação de Friedel-Crafts seja realizada na
presença de um solvente. Se forem dobradas as concentrações
do composto aromático e do cloreto de alquila, a velocidade da
reação será multiplicada por quatro.
Sob determinadas condições, verificou-se que a taxa de produção de oxigênio na reação abaixo é de 8,5 x 10 –5 mol L –1 s –1.
N2O5(g) → N2O4(g) + 1/2 O2(g)
Se a velocidade permanecer constante, ao longo de 5 minutos, a diminuição da concentração de N2O5 será de
Um antiácido comercial em pastilhas possui, em sua composição, entre outras substâncias, bicarbonato de sódio, carbonato de sódio e ácido cítrico. Ao ser colocada em água, a pastilha dissolve‐se completamente e libera gás carbônico, o que causa a efervescência. Para entender a influência de alguns fatoressobre a velocidade de dissolução da pastilha, adicionou‐ se uma pastilha a cada um dos quatro recipientes descritos na tabela, medindo‐se o tempo até a sua dissolução completa.
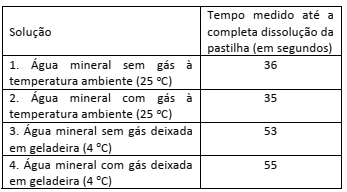
Para todos os experimentos, foi usada água mineral da mesma marca. Considere a água com gás como tendo gás carbônico dissolvido.
Com base nessas informações, é correto afirmar que
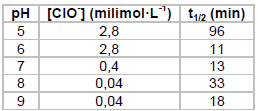
Sendo t1/2 o tempo para a concentração do sarin cair à metade, de acordo com a tabela a reação é mais rápida em
( ) A adição de um catalisador na mistura aumenta o rendimento da reação e promove a formação de outros produtos. ( ) A diminuição do volume ocupado pela mistura gasosa resulta no aumento da velocidade da reação. ( ) A velocidade de decomposição de CH4 é a metade da velocidade de formação de H2O. ( ) A velocidade da reação dobra quando as concentrações de CH4 e O2 forem duplicadas. ( ) A velocidade de formação dos produtos, CO2(g) e H2O(g), da reação de combustão é a mesma.
Assinale a alternativa que contém, de cima para baixo, a sequência correta.
O níquel é empregado na indústria como catalisador de diversas reações, como na reação de reforma do etileno glicol, que produz hidrogênio a ser utilizado como combustível. O processo ocorre num tempo muito menor quando é utilizado 1 g de níquel em uma forma porosa desse material, em comparação à reação utilizando uma única peça cúbica de 1 g de níquel. Abaixo está esquematizada a equação de reforma do etileno glicol e ao lado uma imagem de microscopia eletrônica de uma amostra de níquel na forma porosa.
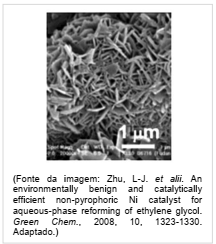
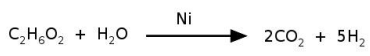
Nas condições mencionadas, a reação de reforma ocorre num tempo menor
quando usado o níquel poroso porque:
A figura a seguir mostra o diagrama de energia da reação A+B→C, ocorrendo via caminho 1 (linha sólida) ou 2 (pontilhado).
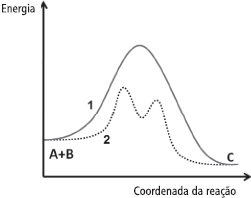
Com base no diagrama, analise os itens a seguir:
I) Existe a formação de um intermediário de reação no caminho 2.
II) Apenas um estado de transição (complexo ativado) está presente no caminho 1.
III) A reação deve se processar mais rapidamente, se ocorrer pelo caminho 1.
IV) O caminho 2 pode representar a reação A+B→C,na presença de um catalisador.
Estão corretos os itens:
