Questões de Vestibular
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 268 questões
A bioluminescência é o fenômeno de emissão de luz visível por certos organismos vivos, resultante de uma reação química entre uma substância sintetizada pelo próprio organismo(luciferina) e oxigênio molecular, na presença de uma enzima (luciferase). Como resultado dessa reaçãobioquímica é gerado um produto em um estado eletronicamenteexcitado (oxiluciferina*). Este produto, por suavez, desativa-se por meio da emissão de luz visível, formandoo produto no estado normal ou fundamental (oxiluciferina).Ao final, a concentração de luciferase permanece constante.

O esquema ilustra o mecanismo geral da reação de bio-luminescência de vagalumes, no qual são formados dois produtos diferentes em estados eletronicamente excitados,responsáveis pela emissão de luz na cor verde ou na cor vermelha.

2 NaHCO3 (s) → Na2CO3 (s) + H 2O (g) + CO2 (g)
Considere o preparo de dois bolos com as mesmas quantidades de ingredientes e sob as mesmas condições, diferindo apenas na temperatura do forno: um foi cozido a 160 oC e o outro a 220 oC. Em ambos, todo o fermento foi consumido.
O gráfico que relaciona a massa de CO2 formada em função do tempo de cozimento, em cada uma dessas temperaturas de preparo, está apresentado em:
Obrigatório desde 1997, o componente reduz as emissões
provenientes da queima de combustível
Na época de frio, a qualidade do ar tende a piorar e, para não tornar a situação ainda mais crítica, é preciso atenção ao catalisador do veículo. A peça pode transformar mais de 90% dos gases tóxicos em derivados menos poluentes. [...]
O principal indício de problemas no catalisador é a perda de potência. “Combustível adulterado provoca a ineficiência da reação química que faz a catálise, o que afeta o rendimento", explica o diretor Associação de Engenharia Automotiva (AEA), Alfredo Castelli.
A cor da fumaça que sai pelo escapamento não está relacionada a defeitos na peça. Nesse caso, indica que há algo de errado com o motor.
Thais Villaça
O Estado de São Paulo, 28.05.14
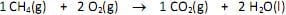
Nessas condições, na queima de 32 mg de metano, será lançada, pelo escapamento do veículo, uma massa de gás carbônico igual a
Dados: H = 1, C = 12, O = 16
Obrigatório desde 1997, o componente reduz as emissões
provenientes da queima de combustível
Na época de frio, a qualidade do ar tende a piorar e, para não tornar a situação ainda mais crítica, é preciso atenção ao catalisador do veículo. A peça pode transformar mais de 90% dos gases tóxicos em derivados menos poluentes. [...]
O principal indício de problemas no catalisador é a perda de potência. “Combustível adulterado provoca a ineficiência da reação química que faz a catálise, o que afeta o rendimento", explica o diretor Associação de Engenharia Automotiva (AEA), Alfredo Castelli.
A cor da fumaça que sai pelo escapamento não está relacionada a defeitos na peça. Nesse caso, indica que há algo de errado com o motor.
Thais Villaça
O Estado de São Paulo, 28.05.14
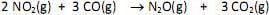
Em um experimento investigativo sobre a velocidade dessa reação, foram realizados três experimentos nas condições mostradas na tabela.
Pode-se prever, considerando apenas os fatores mostrados acima, que a relação entre as velocidades das reações nessas três experiências será
Obrigatório desde 1997, o componente reduz as emissões
provenientes da queima de combustível
Na época de frio, a qualidade do ar tende a piorar e, para não tornar a situação ainda mais crítica, é preciso atenção ao catalisador do veículo. A peça pode transformar mais de 90% dos gases tóxicos em derivados menos poluentes. [...]
O principal indício de problemas no catalisador é a perda de potência. “Combustível adulterado provoca a ineficiência da reação química que faz a catálise, o que afeta o rendimento", explica o diretor Associação de Engenharia Automotiva (AEA), Alfredo Castelli.
A cor da fumaça que sai pelo escapamento não está relacionada a defeitos na peça. Nesse caso, indica que há algo de errado com o motor.
Thais Villaça
O Estado de São Paulo, 28.05.14
CHCl3(g) + Cl2(g) → CCl4(g) + HCl(g).
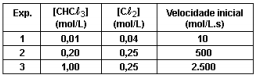
Usando esses dados, assinale o correto.
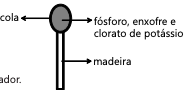
O acendimento instantâneo do palito de fósforo antigo era possível por que a reação entre fósforo branco e oxigênio possui:
CS2(l) + 3O2(g) → CO2(g) + 2SO2(g)
Os automóveis são os principais poluidores dos centros urbanos. Para diminuir a poluição, a legislação obriga o uso de catalisadores automotivos. Eles viabilizam reações que transformam os gases de escapamento dos motores, óxidos de nitrogênio e monóxido de carbono, em substâncias bem menos poluentes.
Os catalisadores ______a energia de ativação da reação no sentido da formação dos produtos,______ a energia de ativação da reação no sentido dos reagentes e______ no equilíbrio reacional.
No texto, as lacunas são preenchidas, correta e respectivamente,
por:
O eugenol, extraído de plantas, pode ser transformado em seu isômero isoeugenol, muito utilizado na indústria de perfumes. A transformação pode ser feita em solução alcoólica de KOH.
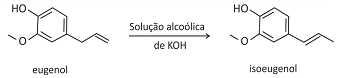
Foram feitos três experimentos de isomerização, à mesma temperatura, empregando-se massas iguais de eugenol e volumes iguais de soluções alcoólicas de KOH de diferentes concentrações. O gráfico a seguir mostra a porcentagem de conversão do eugenol em isoeugenol em função do tempo, para cada experimento.
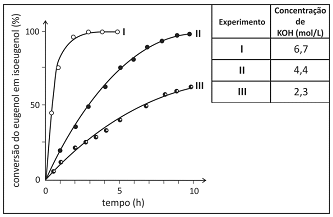
Analisando-se o gráfico, pode-se concluir corretamente que
A (g) + B(g) → C(g)
revelou que sua velocidade inicial era dada pela expressão: v = k [A]a [B]b
Os dados abaixo, na tabela, foram coletados a 25ºC
[A] [B] V(mol/L.s
0,10 0,20 2,5 . 10-6
0,10 0,20 5,0 . 10-6
0,20 0,10 10,0 . 10-6
Os valores de (a) e (b), na expressão da velocidade, são respectivamente,

CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

 e
e  são as velocidades
características das moléculas de H2 e O2,
respectivamente. A seguir, assinale o que for
correto.
são as velocidades
características das moléculas de H2 e O2,
respectivamente. A seguir, assinale o que for
correto.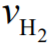 = 4
= 4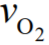 .
. COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Hoje a preocupação sobre poluição atmosférica está voltada ao poluente ozônio troposférico (O3), relacionado ao câncer, à pneumonia e à asma. Paulo Saldiva, do laboratório de poluição atmosférica da USP, afirma que os veículos melhoraram a queima e diminuíram a emissão de CO, entretanto o O3 ainda não está regulamentado. Para Saldiva, o comprador deve checar a emissão de hidrocarbonetos e óxidos nitrosos – que reagem e produzem O3 – se quiser um carro menos inimigo da natureza (Revista Galileu, Ed. Globo, agosto de 2012).
Dadas abaixo algumas reações químicas envolvidas na formação do O3 troposférico e com base no texto acima, assinale o que for correto.
 NO(g) + O(g) etapa 1
NO(g) + O(g) etapa 1 O3(g) etapa 2
O3(g) etapa 2
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Hoje a preocupação sobre poluição atmosférica está voltada ao poluente ozônio troposférico (O3), relacionado ao câncer, à pneumonia e à asma. Paulo Saldiva, do laboratório de poluição atmosférica da USP, afirma que os veículos melhoraram a queima e diminuíram a emissão de CO, entretanto o O3 ainda não está regulamentado. Para Saldiva, o comprador deve checar a emissão de hidrocarbonetos e óxidos nitrosos – que reagem e produzem O3 – se quiser um carro menos inimigo da natureza (Revista Galileu, Ed. Globo, agosto de 2012).
Dadas abaixo algumas reações químicas envolvidas na formação do O3 troposférico e com base no texto acima, assinale o que for correto.
 NO(g) + O(g) etapa 1
NO(g) + O(g) etapa 1 O3(g) etapa 2
O3(g) etapa 2

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar: