Questões de Vestibular
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 271 questões
2 NaHCO3 (s) → Na2CO3 (s) + H 2O (g) + CO2 (g)
Considere o preparo de dois bolos com as mesmas quantidades de ingredientes e sob as mesmas condições, diferindo apenas na temperatura do forno: um foi cozido a 160 oC e o outro a 220 oC. Em ambos, todo o fermento foi consumido.
O gráfico que relaciona a massa de CO2 formada em função do tempo de cozimento, em cada uma dessas temperaturas de preparo, está apresentado em:
A (g) + B(g) → C(g)
revelou que sua velocidade inicial era dada pela expressão: v = k [A]a [B]b
Os dados abaixo, na tabela, foram coletados a 25ºC
[A] [B] V(mol/L.s
0,10 0,20 2,5 . 10-6
0,10 0,20 5,0 . 10-6
0,20 0,10 10,0 . 10-6
Os valores de (a) e (b), na expressão da velocidade, são respectivamente,
Obrigatório desde 1997, o componente reduz as emissões
provenientes da queima de combustível
Na época de frio, a qualidade do ar tende a piorar e, para não tornar a situação ainda mais crítica, é preciso atenção ao catalisador do veículo. A peça pode transformar mais de 90% dos gases tóxicos em derivados menos poluentes. [...]
O principal indício de problemas no catalisador é a perda de potência. “Combustível adulterado provoca a ineficiência da reação química que faz a catálise, o que afeta o rendimento", explica o diretor Associação de Engenharia Automotiva (AEA), Alfredo Castelli.
A cor da fumaça que sai pelo escapamento não está relacionada a defeitos na peça. Nesse caso, indica que há algo de errado com o motor.
Thais Villaça
O Estado de São Paulo, 28.05.14
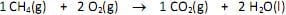
Nessas condições, na queima de 32 mg de metano, será lançada, pelo escapamento do veículo, uma massa de gás carbônico igual a
Dados: H = 1, C = 12, O = 16
Obrigatório desde 1997, o componente reduz as emissões
provenientes da queima de combustível
Na época de frio, a qualidade do ar tende a piorar e, para não tornar a situação ainda mais crítica, é preciso atenção ao catalisador do veículo. A peça pode transformar mais de 90% dos gases tóxicos em derivados menos poluentes. [...]
O principal indício de problemas no catalisador é a perda de potência. “Combustível adulterado provoca a ineficiência da reação química que faz a catálise, o que afeta o rendimento", explica o diretor Associação de Engenharia Automotiva (AEA), Alfredo Castelli.
A cor da fumaça que sai pelo escapamento não está relacionada a defeitos na peça. Nesse caso, indica que há algo de errado com o motor.
Thais Villaça
O Estado de São Paulo, 28.05.14
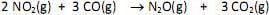
Em um experimento investigativo sobre a velocidade dessa reação, foram realizados três experimentos nas condições mostradas na tabela.
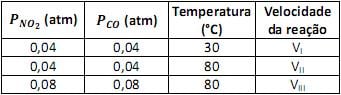
Pode-se prever, considerando apenas os fatores mostrados acima, que a relação entre as velocidades das reações nessas três experiências será
Obrigatório desde 1997, o componente reduz as emissões
provenientes da queima de combustível
Na época de frio, a qualidade do ar tende a piorar e, para não tornar a situação ainda mais crítica, é preciso atenção ao catalisador do veículo. A peça pode transformar mais de 90% dos gases tóxicos em derivados menos poluentes. [...]
O principal indício de problemas no catalisador é a perda de potência. “Combustível adulterado provoca a ineficiência da reação química que faz a catálise, o que afeta o rendimento", explica o diretor Associação de Engenharia Automotiva (AEA), Alfredo Castelli.
A cor da fumaça que sai pelo escapamento não está relacionada a defeitos na peça. Nesse caso, indica que há algo de errado com o motor.
Thais Villaça
O Estado de São Paulo, 28.05.14
A respeito desse processo, foram feitas as seguintes afirmações:
I. O craqueamento é importante economicamente, pois converte frações mais pesadas de petróleo em compostos de grande demanda.
II. O craqueamento libera grande quantidade de energia, proveniente da ruptura de ligações químicas nas moléculas de grande massa molecular.
III. A presença de catalisador permite que as transformações químicas envolvidas no craqueamento ocorram mais rapidamente.
Está correto o que se afirma em
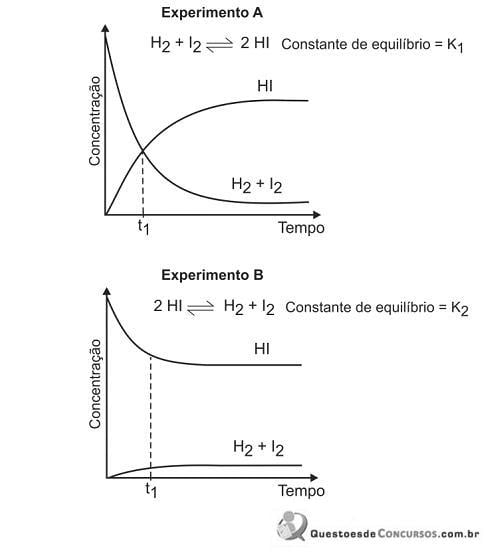
Pela análise dos dois gráficos, pode-se concluir que

• ausência de inibidores;
• presença de concentrações constantes de um inibidor competitivo;
• presença de concentrações constantes de um inibidor não competitivo.
Os resultados estão representados no gráfico abaixo:

As curvas que representam a resposta obtida na presença de um inibidor competitivo e na presença de um não competitivo estão indicadas, respectivamente, pelos seguintes números:

O gráfico abaixo mostra a variação do volume do conteúdo em cada recipiente em função do tempo.

Sabendo que a concentração inicial da solução ácida é igual a 0,10 mol.L-1 , a concentração inicial da solução básica, em mol.L-1 , corresponde a:
Considere as seguintes afirmações sobre estudos cinéticos de uma reação química e assinale a correta.

HBr(g) + NO2(g) → HBrO(g) + NO(g) (lenta) HBr(g) + HBrO(g) → Br2(g) + H2O(g) (rápida)
A partir do mecanismo proposto, é correto afirmar:
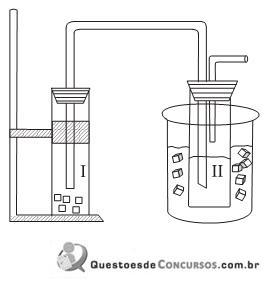
O frasco II, imerso em um banho de água e gelo, contém solução aquosa com carbonato de amônio e 23,4 g de cloreto de sódio. O frasco I, gerador de gás carbônico, contém “gelo seco”, que quando borbulhado na solução do frasco II causa uma reação, produzindo como único produto sólido o bicarbonato de sódio. Decorrido o tempo necessário de reação, os cristais foram separados e secados, obtendo- se 25,2 g de
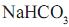 . Considerando que reagente limitante é NaCl, o rendimento percentual desse processo, corretamente calculado pelo grupo de alunos, foi igual a
. Considerando que reagente limitante é NaCl, o rendimento percentual desse processo, corretamente calculado pelo grupo de alunos, foi igual a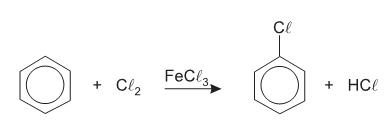
De acordo com esta reação, é CORRETO afirmar que:
B2O3 + 3Mg → 2B + 3MgO
Partindo-se de 262,5 g do óxido de boro em excesso de magnésio, obteve- se 33 g de B, o que significa que o rendimento percentual (%) da reação foi mais próximo de:

Considerando as informações acima, julgue os itens 50 e 51, assinale a opção correta no item 52, que é do tipo C, e faça o que se pede no item 53, que é do tipo D.
O lança-perfume é uma droga inalante consumida principalmente no Carnaval. É constituído por solventes voláteis que, quando inalados, são levados, via corrente sanguínea, para todo o organismo. Por induzir a produção de adrenalina no organismo, a droga acelera a frequência cardíaca, proporcionando sensação de euforia e desinibição, ao mesmo tempo em que confere
perturbações auditivas e visuais, perda de autocontrole e visão confusa. O cloreto de etila
 e o éter dietílico
e o éter dietílico  , componentes principais do lança-perfume, podem ser sintetizados a partir do
, componentes principais do lança-perfume, podem ser sintetizados a partir do  , de acordo com as
, de acordo com asreações a seguir.

Considerando as reações acima e os valores de entalpias padrão de
formação —
 — a 25 ºC, apresentados na tabela, julgue os itens seguintes.
— a 25 ºC, apresentados na tabela, julgue os itens seguintes. 
