Questões de Vestibular
Sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 271 questões
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)
1) Na água com gás a velocidade de reação deve ser menor do que em água natural.
2) Em água gelada a velocidade de reação deve ser menor que em água natural.
3) No terceiro dia a vitamina C efervescente se dissolveu mais rápido que nos dias anteriores.
Está(ão) correta(s) apenas:
À partir dessas informações, foram feitas três afirmações:
1) À temperatura ambiente, as moléculas dos componentes da gasolina e as do oxigênio não têm energia suficiente para iniciar a combustão.
2) A reação de combustão entre as moléculas dos componentes da gasolina e as do oxigênio pode ser iniciada na presença de um cigarro aceso, provocando uma explosão.
3) Entre as moléculas dos componentes da gasolina podemos encontrar compostos derivados do benzeno, que são compostos cancerígenos.
Está(ão) correta(s) a(s) afirmativa(s):
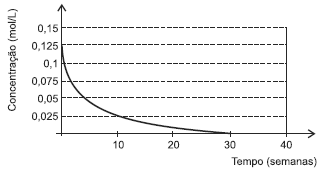
Na administração de um antibiótico por um médico, durante uma enfermidade, observou-se a variação de concentração em molL−1 , em função do tempo, por semana do medicamento, conforme representado no gráfico.
A análise do gráfico permite corretamente concluir:
FELIPE: Congelar a peça inteira de carne, tirar pela manhã para descongelar e cortar os pedaços desejados, voltando a peça para o freezer. LUCAS: Cortar doze porções de carne, congelá-las individualmente e descongelar apenas a porção que será preparada, fazendo os bifes na hora. PEDRO: Cortar todos os bifes, guardar na geladeira (sem congelar), retirar a porção desejada e comê-los frescos a cada dia. MARCELO: Guardar a peça de carne inteira na geladeira e diariamente cortar os bifes que serão utilizados, voltando a peça para a geladeira.
INDIQUE o estudante que considerou os efeitos cinéticos adequados à conservação da carne
Analise o esquema.
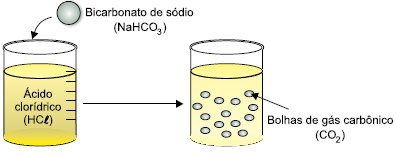
Admita que a reação ocorrida seja instantânea.
Se a velocidade de consumo do bicarbonato de sódio foi
2,5 × 10–3
mol/L × s, a velocidade de formação do gás carbônico foi de
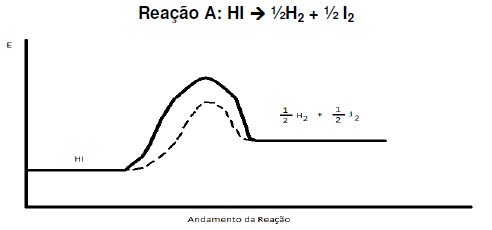
Marque a opção correta:
Para que uma reação química aconteça, as moléculas dos reagentes devem colidir com geometria favorável e devem possuir energia suficiente. Se essas duas condições forem atingidas ocorrerá a formação do complexo ativado, o qual corresponde a um estado de transição. Existem vários fatores que influenciam na rapidez das reações, por exemplo, a superfície de contato e a temperatura. O gráfico mostra a variação da energia cinética das moléculas em baixa e alta temperatura. Sobre a influência do aumento da temperatura para a formação do complexo ativado e na rapidez das reações químicas foram feitas as afirmações abaixo
I. Com o aumento da temperatura, um maior número de moléculas irá possuir energia sufi ciente para atingir o estado de ativação.
II. O aumento da temperatura aumenta o número de colisões entre as moléculas dos reagentes e, consequentemente, aumentam os choques não eficazes e os eficazes.
III. Para que ocorra a formação do complexo ativado, as moléculas dos reagentes devem possuir uma quantidade de energia no mínimo igual à energia de ativação e, portanto, o aumento de temperatura favorece a formação do complexo ativado.
IV. A formação do complexo ativado ocorre apenas em reações endotérmicas.
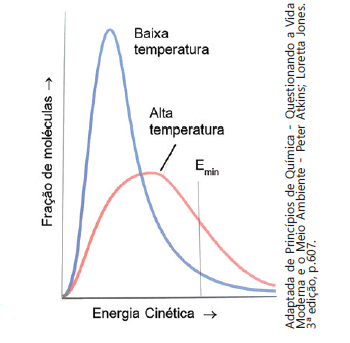
As afirmativas corretas são:
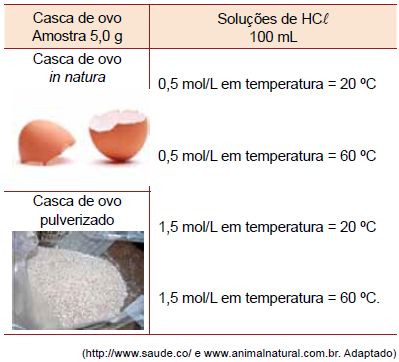
O experimento consistia em medir o tempo da reação da solução ácida com a amostra de casca de ovo. Para a preparação do experimento, foi removida a película de material orgânico que compõe a casca de ovo, tanto para o seu uso in natura como para preparação da amostra em pó.
A combinação que apresentou o menor tempo de reação foi aquela que usou
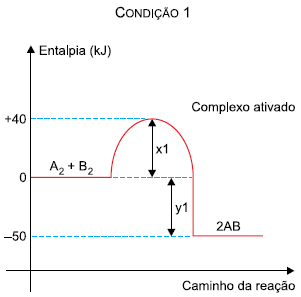
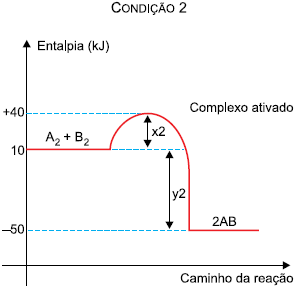
Na comparação entre as duas condições, verifica-se que:
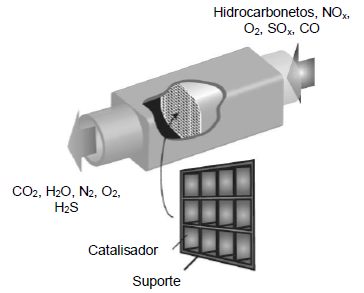
Figura adaptada de Duward Shriver et al., Inorganic Chemistry, 6 ed., 2014.
Sobre o processo de catálise ilustrado acima, é correto afirmar o que segue
(CH3)3CBr(aq) + OH- (aq) → (CH3)3COH(aq) + Br- (aq)
Experimentos foram realizados para o estudo da cinética reacional, à temperatura constante de 60°C.
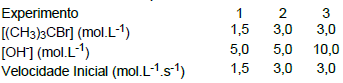
Baseado nos experimentos descritos acima, qual a lei de velocidade para a formação do terc-butanol?
No corpo humano, o álcool é removido da corrente sanguínea por uma série de reações metabólicas. A primeira reação produz etanal, de acordo com a equação química abaixo:
[O]
CH3CH2OH → CH3CHO
Foi realizado o acompanhamento da variação da concentração de etanol [C2H5OH] no sangue de um indivíduo alcoolizado para determinar a velocidade (v) pela qual o etanol é removido do sangue através das reações que ocorrem no organismo:
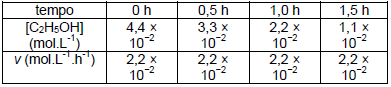
A partir dos dados fornecidos, assinale a alternativa
que contém os dados corretos para a equação da
velocidade da reação, o valor da constante de
velocidade e a ordem da reação.
1) A velocidade de uma reação química geralmente diminui com o aumento da temperatura.
2) A velocidade de uma reação química depende da concentração dos reagentes.
3) A velocidade de uma reação química independe da orientação apropriada das moléculas no momento do choque.
4) Para os sólidos, quanto maior a superfície de contato, maior será a velocidade da reação química.
Estão corretas apenas: