Questões Militares
Sobre equilíbrio químico em química
Foram encontradas 197 questões

Para avaliar a fertilidade de um solo, podem ser utilizados indicadores de pH, substâncias que mudam de cor em função da acidez ou da alcalinidade do meio em que são empregadas. Considere um agricultor que utilizou um indicador de pH com a seguinte sequência de cores:

Sabe-se que no solo avaliado pelo agricultor, podem ser encontrados os sais Al2 (SO4 ) 3 , Na2 CO3 KNO3 e NaCl e que, o indicador de pH apontou coloração vermelha.
Com base nesse resultado, conclui-se que o solo avaliado apresenta o seguinte sal:
Considere as curvas de solubilidade.
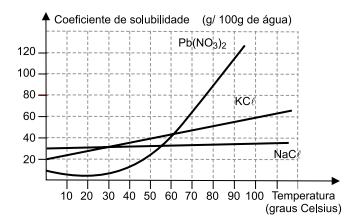
(Estudo gráfico do coeficiente de solubilidade – Manual da Química (manualdaquimica.com))
Ao preparar soluções aquosas com cada um dos sais,
separadamente, dissolvendo 10 g do sal em 50 g de
água a 40 ºC, observa-se formação de corpo de fundo
na solução de
2 H2 S(g) + SO2 (g)
 3 S(s) + 2 H2
O(g); ΔH < 0
3 S(s) + 2 H2
O(g); ΔH < 0 Ocorre o deslocamento do equilíbrio no sentido dos produtos quando, nesse sistema,
 2SO3
(g), uma das etapas de formação do ácido sulfúrico, apresentou os
seguintes valores de pressões parciais à temperatura de
726 ºC.
2SO3
(g), uma das etapas de formação do ácido sulfúrico, apresentou os
seguintes valores de pressões parciais à temperatura de
726 ºC. 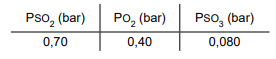
A constante de equilíbrio para esse sistema tem valor de
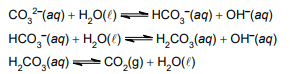
A solução tampão formada nesse sistema envolve o par conjugado ácido-base, nessa ordem:
Tabela. Dados de amostras de acordo com suas concentrações hidrogeniônicas e hidroxiliônicas.
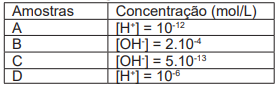
Use: log2= 0,3; log5= 0,7 (aproximações)
De acordo com os dados presentes na tabela, assinale a alternativa correta, quanto à acidez, à neutralidade ou à basicidade das amostras A, B, C e D.
Foram misturados sob agitação Ag2S sólido e uma solução de saturada de H2S (0,1 mol/L) em H+ (0,15 mol/L).
Considerem-se as constantes de equilíbrio a 25 ºC:
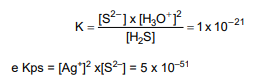
Nessa temperatura, ao se atingir o equilíbrio, a concentração de íons Ag+ na solução será:
Um procedimento para obtenção de estanho metálico foi realizado a partir do óxido de estanho (IV), em um compartimento selado que, após ser evacuado, foi preenchido com gás hidrogênio. Ao ser atingido o equilíbrio químico a 900 K, a atmosfera gasosa no interior do compartimento era composta por 45% gás hidrogênio, em volume.
A constante de equilíbrio, Kp, para essa reação a 900 K é igual a, aproximadamente,
Considere os seguintes pares de compostos:
I. HF e HI
II. NH3 e H2O
III. C2 H2 e C2 H4
Os compostos que apresentam maior acidez (menor valor de pKa) em I, II e III são, correta e respectivamente:


2A + B ⇆ C + D + Q
em que A e B são reagentes, C e D os produtos e Q o calor liberado. Avalie as seguintes suposições sobre o efeito das modificações de um parâmetro da reação, mantendo os outros constantes.
I. Conduzir a reação a 600 °C gera uma fração maior de C e D.
II. Conduzir a reação a 600 °C faz com que o equilíbrio seja alcançado em menos de 60 min.
III. Conduzir a reação a uma pressão de 100 atm gera uma fração menor de C e D.
IV. Remover C e D do meio reacional após o equilíbrio e então retomar a reação permitem obter uma fração total maior de C e D.
Escolha a opção que lista a(s) afirmação(ões) CORRETA(S).
Em um experimento laboratorial, misturou-se 25 mL de uma solução aquosa de ácido clorídrico com concentração 0,8 mol L-1 com 25 mL de uma solução aquosa de hidróxido de sódio com concentração 0,6 mol L-1 .
Acerca do experimento, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de neutralização.
II – A substância de caráter alcalino (básico) está em excesso estequiométrico.
III – A solução resultante após a reação possui caráter ácido.
IV – Após a reação, o pH da solução resultante possui valor igual a 2.
Das afirmativas feitas, estão corretas apenas
Visando estudar o equilíbrio a seguir, um experimentador adicionou quantidades equimolares de tricloreto de fósforo e cloro gasoso em um reator a 180 °C.
PCl3(g) + Cl2(g) ⇌ PCl5(g)
Atingido o equilíbrio, foi verificada uma concentração de 1 x 10−4 mol/L de pentacloreto de fósforo.
Admitindo que, a 180 °C, a constante do equilíbrio em apreço
seja igual a 0,64, assinale a opção que indica a concentração de
cloro gasoso presente no equilíbrio.