Questões Militares de Química - Equilíbrio Químico
Foram encontradas 200 questões
Industrialmente, o PCl5 é sintetizado em reator fechado por meio da cloração do PCl3, de acordo com a equação química a seguir.
PCl3(g) + Cl2(g) ⇌ PCl5(g) ΔH = −124 kJ/mol
Conforme o princípio de Le Châtelier, o rendimento desse
processo pode ser aumentado
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio


Sabe-se que a bateria converte Pb e PbO2 em PbSO4 na descarga e que, em condições normais, o pH da solução eletrolítica é menor que 1.
A respeito dessa bateria, foram feitas as seguintes afirmações:
I. Em condições normais, durante a descarga, a semirreação principal que ocorre no ânodo é a i e, no cátodo, é a iv. II. Em condições normais, o potencial da bateria no equilíbrio pode ser representado por E = 1,93 − 0,06pH + 0,06log
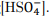 III. Em condições padrão, a eletrólise da água sempre acontece.
IV. Em pH ∼ 2, os potenciais das semirreações secundárias igualam-se aos potenciais das semirreações
principais do ânodo e do cátodo, respectivamente, portanto a eletrólise da água não ocorre
quando o eletrólito tem pH > 2.
III. Em condições padrão, a eletrólise da água sempre acontece.
IV. Em pH ∼ 2, os potenciais das semirreações secundárias igualam-se aos potenciais das semirreações
principais do ânodo e do cátodo, respectivamente, portanto a eletrólise da água não ocorre
quando o eletrólito tem pH > 2. Considerando apenas argumentos baseados no equilíbrio termodinâmico a 25 °C, está(ão) ERRADA(S) apenas a(s) afirmação(ões)
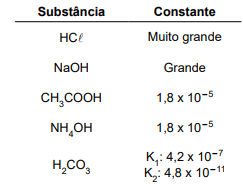
Substância Constante HCl Muito grande NaOH Grande CH3COOH 1,8 x 10–5 NH4OH 1,8 x 10–5 H2CO3 K1 : 4,2 x 10–7 K2 : 4,8 x 10–11
T (ºC) Kw 10 0,29 × 10–14 15 0,45 × 10–14 20 0,68 × 10–14 25 1,01 × 10–14 30 1,47 × 10–14 50 5,48 × 10–14
Os valores de Kw mostram que, a 50 ºC, o pH da água pura é
2 SO2 (g) + O2(g) ⇌ 2 SO3(g) Temperatura, K Constante, Kc 300 4 x 1024 500 2,5 x 1010 700 3,0 x 104
As melhores condições para que a formação do produto seja favorecida são:

Com base nessas informações, é correto afirmar que:
Uma das atividades em que os militares do Corpo de Bombeiros precisam atuar com muita sabedoria é no combate ao incêndio. A exposição dos militares bombeiros ainda é maior em incêndios florestais, uma vez que o uso de equipamentos de proteção fica limitado e os riscos de intoxicação pela fumaça contendo monóxido de carbono são eminentes. O monóxido de carbono tem habilidade de se ligar muito fortemente a hemoglobina (Hb), uma proteína que contém ferro nas células de glóbulos vermelhos. Nessa ligação, forma-se o complexo carboxihemoglobina (COHb). A ligação do oxigênio com a hemoglobina forma a oxihemoglobina(O2Hb).
A respeito do texto descrito, considere o seguinte equilíbrio:
O2Hb (aq) + CO (g)⇌COHb (aq) + O2 (g) K > 1
Do ponto de vista do equilíbrio químico, quando o indivíduo respira muito monóxido de carbono,
Os principais parâmetros que definem a qualidade da água de uma piscina são o pH e a alcalinidade. Para a água ser considerada própria, o pH deve ser mantido próximo de 7,0, para garantir o conforto do banhista e a eficácia dos agentes bactericidas. Já a alcalinidade, expressa em concentração de íon bicarbonato, deve ser em torno de 100 g m-3 . A propriedade anfotérica desse íon garante que qualquer substância ácida ou básica introduzida seja prontamente neutralizada, conforme mostram as equações químicas abaixo:
HCO3- (aq) + H+ (aq) ⇄ H2O(l) + CO2(g)
HCO3- (aq) + OH- (aq) ⇄ H2O(l) + CO32-(aq)
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o
banho, ocorrerá:
Considere a tabela dos valores de Kw a diferentes temperaturas.
T (ºC) Kw
10 0,29 × 10–14
15 0,45 × 10–14
20 0,68 × 10–14
25 1,01 × 10–14
30 1,47 × 10–14
50 5,48 × 10–14
Os valores de Kw mostram que, a 50 ºC, o pH da água
pura é

As melhores condições para que a formação do produto seja favorecida são:
Os principais parâmetros que definem a qualidade da água de uma piscina são o pH e a alcalinidade. Para a água ser considerada própria, o pH deve ser mantido próximo de 7,0, para garantir o conforto do banhista e a eficácia dos agentes bactericidas. Já a alcalinidade, expressa em concentração de íon bicarbonato, deve ser em torno de 100 g m-3 . A propriedade anfotérica desse íon garante que qualquer substância ácida ou básica introduzida seja prontamente neutralizada, conforme mostram as equações químicas abaixo:
HCO3 - (aq) + H+ (aq) ⇄ H2O(l) + CO2(g)
HCO3 - (aq) + OH- (aq) ⇄ H2O(l) + CO3 2- (aq)
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o banho, ocorrerá: