Questões Militares
Sobre equilíbrio químico em química
Foram encontradas 200 questões
A hidrazina é um composto químico cuja fórmula química é N2H4 . Ela é usada, entre outras aplicações, como propelente para satélites artificiais, para produção de produtos químicos da agricultura e como removedor de oxigênio de caldeira. Usualmente, uma de suas principais reações conhecidas é a liberação dos gases quentes, quando em contato com um oxidante.
Considere a reação:
2N2H4(l) + N2O4(l) ↔ 3N2(g) + 4H2O(g) ΔH = -1094KJ
Interpretando a reação acima, o equilíbrio da reação desloca-se no sentido dos produtos
A afirmativa a seguir contextualiza a questão. Leia‐a atentamente.
“A corrosão é a deterioração de um material, geralmente metálico, por ação química ou eletroquímica do meio ambiente associada ou não a esforços mecânicos.”
(GENTIL, V. corrosão. LTC. 6ª ed. 2012.)
Analise a reação a seguir com seus respectivos sentidos:
• Mn+ + e– → M (sentido 1).
• M → Mn+ + e– (sentido 2).
Considerando o princípio de Le Châtelier, o equilíbrio da reação será influenciado no sentido 1 de acordo com qual
alternativa?
“Solução tampão é uma solução que tem o efeito de manter o pH do meio aproximadamente constante, quando nele são introduzidos íons H+ ou OH– .” Sendo assim, analise as reações a seguir:
I. Solução de HCN + solução de NaCN.
II. Solução de CH3COOH + solução de CH3COONa.
III. Solução de NH4OH + solução NH4Br.
IV. Solução de H2SO4 + solução de CaSO4.
Das reações anteriores, assinale, a seguir, aquela que NÃO é utilizada como solução tampão.
CONSTANTES

DEFINIÇÕES


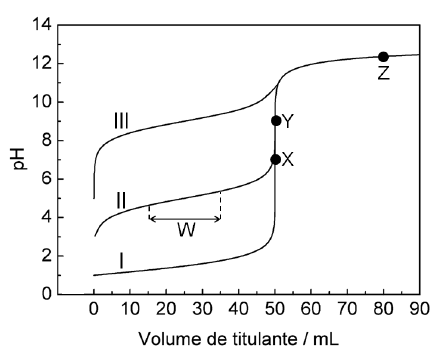
Na figura ao lado são respectivamente apresentadas as curvas de titulação de 50 mL de soluções aquosas 0,1 mol·L-1 dos ácidos I, II e III, tituladas com uma solução aquosa 0,1 mol·L-1 em NaOH. Baseado nas informações contidas na figura, assinale opção ERRADA.
Com relação à natureza de precipitados, analise as afirmativas a seguir.
I - Na análise gravimétrica, o precipitado formado deve ser bastante solúvel.
II - Nos procedimentos clássicos, o reagente precipitante deve ser adicionado diluído e com agitação.
III - As partículas dos precipitados formados devem ser pequenas o suficiente para atravessarem os poros dos filtros.
Assinale a opção correta.
Dados: log (10-1)= -1 log (10-2)= -2 log (10-3 )= -3 log (10-5)= -5 log (10-7)= -7
H2S = H+ + HS- HS- = H+ + S-2
K1=1,1.10-⁷
K2=10-14
As reações acima representam a ionização do ácido sulfídrico em água. Numa solução de 0,11 M de H2S, quala [H+]?
Considere a reação, em equilíbrio, de produção do alvejante gasoso dióxido de cloro, que ocorre em um sistema reacional:
Cl2(g) + 2 NaClO2(s) ⇄ 2 ClO2(g) + 2 NaCl(s)
Nessa situação, assinale a alternativa correta.
Os corais fixam-se sobre uma base de carbonato de cálcio (CaCO3), produzido por eles mesmos. O carbonato de cálcio em contato com a água do mar e com o gás carbônico dissolvido pode estabelecer o seguinte equilíbrio químico para a formação do hidrogenocarbonato de cálcio:
CaCO3 (s) + CO2 (g) + H2O (l) 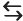 Ca(HCO3)2 (aq)
Ca(HCO3)2 (aq)
Considerando um sistema fechado onde ocorre o equilíbrio químico da reação mostrada acima,
assinale a alternativa correta.
Considere que o pH estomacal seja igual a 2. Quando o fármaco ácido acetilsalicílico (AAS) é ingerido, no estômago sofre ionização em meio aquoso, estabelecendo o seguinte equilíbrio:
AAS(s) + H2O(l)  H3O+(aq) + AAS–(aq) ΔH < 0
H3O+(aq) + AAS–(aq) ΔH < 0
Nessas condições, é CORRETO afirmar que a ionização do AAS é:
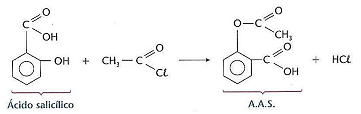
De acordo com o exposto, analise as afirmativas a seguir.
I. Na reação apresentada anteriormente o nome oficial do haleto de acila e do ácido salicílico é cloreto de etanoíla e ácido 2‐hidróxi‐benzóico.
II. Uma solução de 0,015 mol/L de aspirina com pH = 3 possui uma constante de dissociação ácida igual a 1,3 x 10–3.
III.A porcentagem de ácido ionizada na solução de 0,20 mol/L de aspirina com pH = 5 é 1,7%.
Está(ão) correta(s) a(s) afirmativa(s)
(Dados: log 1,49 = 0,17 e log 1,18 = 0,07.)
H+ (aq) + HCO– 3(aq)↔ H2CO3(aq) ↔ H2O(l) + CO2(g)
A regulagem do pH do plasma sanguíneo relaciona‐se diretamente ao transporte efetivo de O2 para os tecidos corpóreos. O oxigênio é carregado pela proteína hemoglobina encontrada nas células de glóbulos vermelhos. A hemoglobina (Hb) liga‐se reversivelmente tanto ao H+ quanto ao O2.
HbH+ + O2↔ HbO2 + H+
De acordo com as reações apresentadas, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Durante períodos de esforço vigoroso grandes quantidades de CO2 são produzidas pelo metabolismo, que desloca o equilíbrio para a direita, diminuindo o pH.
( ) Quando o sangue atinge os tecidos nos quais a concentração de O2 é baixa, o equilíbrio desloca‐se para a esquerda e O2 é liberado.
( ) Durante períodos de esforço vigoroso, à medida que O2 é consumido, o equilíbrio desloca‐se para a direita de acordo com o princípio de Le châtelier.
( ) A remoção de CO2 por exalação desloca o equilíbrio para a direita, consumindo íons H+ .
A sequência está correta em