Questões Militares
Sobre equilíbrio químico em química
Foram encontradas 196 questões
Marque a opção correta.
Para a reação representada abaixo, a constante de equilíbrio, Keq, é descrita como:

Considere as duas reações representadas a seguir:
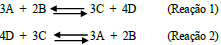
Se Keq para a reação 1 é igual a 0,1, qual é o Keq para a reação 2?
Marque a opção correta.
A dissociação do ácido acético em água ocorre de acordo com a seguinte equação:

Ao adicionar acetato de sódio ao sistema representado acima, supõe-se que o(s) efeito(s) observado(s) é(são):
I. pH diminui.
II. pH aumenta.
III. pKa diminui.
IV. pKa aumenta.
Dado Kps(MX) = 5 x 10─12.
São feitas as seguintes comparações de valores de pKa de compostos orgânicos:
I. pKa (CH3COOH) > pKa (CℓCH2COOH)
II. pKa (F3CCOOH) > pKa (Cℓ3CCOOH)
III. pKa (CH3CH2CHCℓCOOH) > pKa (CH3CHCℓCH2COOH)
Das comparações acima, está(ão) CORRETA(S) apenas
A 25 °C, três frascos (I, II e III) contêm, respectivamente, soluções aquosas 0,10 mol L−1 em acetato de sódio, em cloreto de sódio e em nitrito de sódio.
Assinale a opção que apresenta a ordem crescente CORRETA de valores de pHx (x = I,II e III) dessas soluções, sabendo que as constantes de dissociação (K) , a 25 °C, dos ácidos clorídrico (HCl) , nitroso (HNO2) e acético (CH3COOH) , apresentam a seguinte relação:
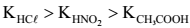
Considere uma amostra aquosa em equilíbrio a 60 °C, com pH de 6,5, a respeito da qual são feitas as seguintes afirmações:
I. A amostra pode ser composta de água pura.
II. A concentração molar de H3O+ é igual à concentração de OH − .
III. O pH da amostra não varia com a temperatura.
IV. A constante de ionização da amostra depende da temperatura.
V. A amostra pode ser uma solução aquosa 0,1mol.L−1em H2 CO3, considerando que a constante de dissociação do H2 CO3 é da ordem de 1 x 10−7 .
Das afirmações acima está(ão) CORRETA(S) apenas
São descritos três experimentos (I, II e III) utilizando-se em cada um 30 mL de uma solução aquosa saturada, com corpo de fundo de cloreto de prata, em um béquer de 50 mL a 25 °C e 1 atm:
I. Adiciona-se certa quantidade de uma solução aquosa 1 mol.L−1 em cloreto de sódio.
II. Borbulha-se sulfeto de hidrogênio gasoso na solução por certo período de tempo.
III. Adiciona-se certa quantidade de uma solução aquosa 1 mol.L−1 em nitrato de prata.
Em relação aos resultados observados após atingir o equilíbrio, assinale a opção que apresenta o(s)
experimento(s) no(s) qual(is) houve aumento da quantidade de sólido.
São feitas as seguintes afirmações a respeito dos produtos formados preferencialmente em eletrodos eletroquimicamente inertes durante a eletrólise de sais inorgânicos fundidos ou de soluções aquosas de sais inorgânicos:
I. Em CaCl2 (l) há formação de Ca s) no catodo.
II. Na solução aquosa 1×10-3mol.L −1 −em Na2SO4 há aumento do pH ao redor do anodo.
III. Na solução aquosa 1mol.L−1 em AgNO3 há formação de O2 (g) no anodo.
IV. Em NaBr (l) há formação de Br2 (l) no anodo.
Das afirmações acima, está(ão) ERRADA(S) apenas
A 25 °C, a força eletromotriz da seguinte célula eletroquímica é de 0,45 V: Pt(s)|H2 (g, 1 atm) | H+ ( mol.L-1)|| KCl (0,1 mol.L -1) | Hg2 Cl2 (s) | Hg(l)| Pt (s) Sendo o potencial do eletrodo de calomelano – KCl (0,1 mol.L -1)| Hg2 Cl2 (s)| Hg(l)
– nas condições-padrão
igual a 0,28 V e x o valor numérico da concentração dos íons H+
, assinale a opção com o valor aproximado do
Ag+ (aq) + e-
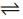 Ag(c); Eo = 0,799 e AgCl (c) + e-
Ag(c); Eo = 0,799 e AgCl (c) + e- 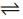 Ag(c) Cl- (aq); E = 0,222 V
Ag(c) Cl- (aq); E = 0,222 Vem que ο Eo é o potencial do eletrodo em relação ao eletrodo padrão de hidrogênio nas condições-padrão.
Considere o produto de solubilidade (K ps), a 25 0C , das substâncias I II e III:
I. Cα (OH)2; K ps = 5,0 × 10 −6II. Mg (OH)2; K ps = 5,6 × 10 −12
III . Zn (OH)2; K ps = 3,0 × 10 −17
Uma alíquota de uma solução aquosa constituída de haletos de sódio foi adicionada a uma solução aquosa de nitrato de prata, com formação de um precipitado. À mistura contendo o precipitado, foi adicionada uma alíquota de solução aquosa diluída de hidróxido de amônio, com dissolução parcial do precipitado. Ao precipitado remanescente, foi adicionada uma alíquota de solução aquosa concentrada de hidróxido de amônio, verificando-se uma nova dissolução parcial do precipitado.
Sabendo que a mistura de haletos é constituída pelo fluoreto, brometo, cloreto e iodeto de sódio, assinale a alternativa CORRETA para o(s) haleto(s) de prata presente(s) no precipitado não dissolvido.
N2(g) + O2(g) ⇌ 2NO(g) K1 2NO(g) + O2(g) ⇌ 2NO2(g) K2
NO2(g) ⇌ 1/2 N2(g) + O2(g) K3
I - O eletrodo de vidro não é um eletrodo de referência, pois é sensível ao pH.
II - O eletrodo indicador do primeiro tipo consiste de um metal em contato com uma solução contendo íons do próprio metal.
III- Um equipamento potenciomêtrico necessita de um eletrodo de referência, um eletrodo indicador e de um dispositivo para leitura de potencial.
Assinale a opção correta.