Questões Militares
Sobre equilíbrio químico em química
Foram encontradas 200 questões
Analise as afirmativas abaixo.
I - quando Vb = ½ Ve , pH = pKa .
II - no ponto de equivalência, o pH será > 7,0
III- no ponto de equivalência, o pH será < 7,0
IV- a fenolftaleína (pH 8,0-9,6) pode ser usada como indicador.
V - o vermelho de metila (pH 4, 8-6, 0) pode ser usado como indicador.
Em relação a uma titulação de ácido acético 0,1M com
hidróxido de sódio 0,1M, é correto afirmar que:
Analise a tabela a seguir.
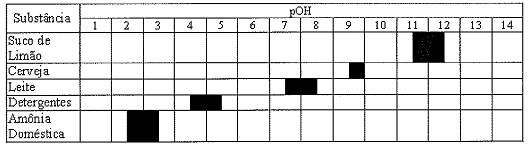
A tabela acima apresenta valores típicos de poH de soluções
comuns em água. Qual das soluções constantes dessa tabela
apreenta [H3O+] >
10-3 mol.L-1 ?
Observe a reação química a seguir.
CS2 (g) + 4H2 (g)  CH4 (g) + 2H2S
CH4 (g) + 2H2S
Em relação à reação química acima, assinale a opção que
apresenta a relação correta entre a lei da ação das massas,
as concentrações molares e a constante de equilíbrio da reação.
Analise a tabela a seguir.
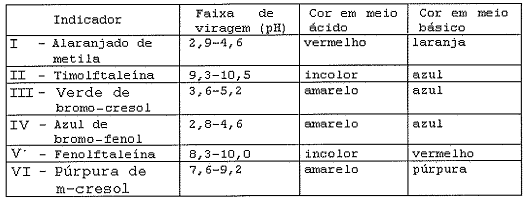
A tabela acima trata de algumas substâncias que podem ser utilizadas como indicadores de neutralização.
Que indicadores dessa tabela poderão ser utilizados para que
seja realizada a titulação de uma solução de amônia com
ácido clorídico?
Observe a tabela abaixo.
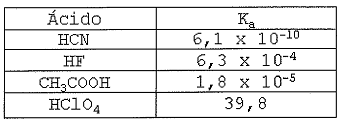
A tabela acima apresenta ácidos com suas respectivas constantes
de ionização (ka) . Assinale a opção que apresenta a
ordem decrescente de ionização desses ácidos.
Um erlenmeyer contém 10,0 mL de uma solução de ácido clorídrico, juntamente com algumas gotas de uma solução de fenolftaleína. De uma bureta, foi-se gotejando uma solução 0,100 M de hidróxido de sódio até o aparecimento de leve coloração rósea. Nesse momento, observou-se um consumo de 20,0 mL da solução alcalina. Pode-se afirmar que a concentração de HCl na solução ácida original era de:
Dados:
Massas atômicas: H = 1,00 u, O = 16,0 u, Na = 23,0 u, Cl = 35,5 u

A respeito dessa reação, são feitas as seguintes afirmações:
I – a reação direta trata-se de um processo exotérmico;
II – o denominador da expressão da constante de equilíbrio em termos de concentração molar (Kc) é igual a [H2O]·[C];
III – se for adicionado mais monóxido de carbono (CO(g)) ao meio reacional, o equilíbrio será deslocado para a esquerda, no sentido dos reagentes;
IV – o aumento na pressão total sobre esse sistema não provoca deslocamento de equilíbrio.
Das afirmações feitas, utilizando os dados acima, está(ão) correta(s):
Considere o produto de solubilidade (K ps), a 25 0C , das substâncias I II e III:
I. Cα (OH)2; K ps = 5,0 × 10 −6II. Mg (OH)2; K ps = 5,6 × 10 −12
III . Zn (OH)2; K ps = 3,0 × 10 −17
Uma alíquota de uma solução aquosa constituída de haletos de sódio foi adicionada a uma solução aquosa de nitrato de prata, com formação de um precipitado. À mistura contendo o precipitado, foi adicionada uma alíquota de solução aquosa diluída de hidróxido de amônio, com dissolução parcial do precipitado. Ao precipitado remanescente, foi adicionada uma alíquota de solução aquosa concentrada de hidróxido de amônio, verificando-se uma nova dissolução parcial do precipitado.
Sabendo que a mistura de haletos é constituída pelo fluoreto, brometo, cloreto e iodeto de sódio, assinale a alternativa CORRETA para o(s) haleto(s) de prata presente(s) no precipitado não dissolvido.
Considere os seguintes dados: Kps AgCl = 1, 5.10-10 e Kps Ag2CrO4 = 3, 2 .10-12
Adicionando-se AgNO3 0,1M a uma solução que é 0,1M, em relação ao cloreto, e 2.10-3 M, em relação ao cromato, é correto afirmar que:
Uma solução aquosa saturada de gás sulfídrico possui concentração igual a 0,1M e constante de ionização igual a 10-22 Calcule a concentração de sulfeto necessária para precipitação dos cátions do segundo Grupo, sabendo-se que o pH deve ser regulado para se obter uma solução 0,25M em ácido clorídrico, e assinale a opção correta.
Dados: H2S → 2 H+ + S-2
Analise o esquema a seguir.
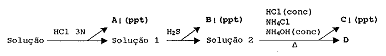
O esquema simplificado acima mostra as etapas percorridas
por uma solução contendo os cátions: Al+3, Ag+1 ,
Ca+2, Cu+2 . As letras A, B, C e D representam, respectivamente, os cátions:
Um técnico em química, após buscar 4 reagentes no almoxarifado, verificou que os rótulos dos mesmos estavam ilegíveis. Sabendo-se que em cada frasco contém apenas um cátion, o técnico fez as seguintes experiências:
Frasco 1 + H2S -> precipitado preto
Frasco 1 + KI -> precipitado preto
Frasco 2 + NH4SCN -> coloração vermelha
Frasco 2 + NaOH → precipitado castanho
Frasco 3 + H2S → precipitado preto
Frasco 3 + dimetilglioxima → precipitado vermelho
Frasco 4 + uranil acetato de zinco → precipitado amarelo esverdeado
Frasco 4 + K2H2Sb2O7 → precipitado branco
De acordo com as experiências acima, é correto afirmar que
os cátions presentes nos frascos 1, 2, 3 e 4, são,
respectivamente:
Considere uma amostra aquosa em equilíbrio a 60 °C, com pH de 6,5, a respeito da qual são feitas as seguintes afirmações:
I. A amostra pode ser composta de água pura.
II. A concentração molar de H3O+ é igual à concentração de OH − .
III. O pH da amostra não varia com a temperatura.
IV. A constante de ionização da amostra depende da temperatura.
V. A amostra pode ser uma solução aquosa 0,1mol.L−1em H2 CO3, considerando que a constante de dissociação do H2 CO3 é da ordem de 1 x 10−7 .
Das afirmações acima está(ão) CORRETA(S) apenas